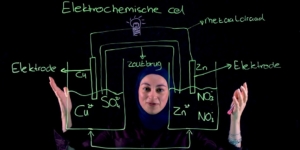
Dit doet ze aan de hand van een opgave uit een oud-eindexamen: vraag 11 uit het havo examen 2019, tijdvak 1: "Geef de vergelijking van de volledige verbranding van diesel. Gebruik de formule C14H30 voor diesel."
Mimi legt stap voor stap uit hoe je deze vergelijking opstelt.
Geen zin om een filmpje te bekijken? Hieronder lees je de tekst:
Hi, ik ben Mimi van de Sisters in Science en vandaag ga ik laten zien hoe je een kloppende reactievergelijking opstelt.
We gaan dat doen aan de hand van een oud examen: 2019 tijdvak 1 vraag 11, van het havo-eindexamen.
In deze opgave vragen ze om de reactievergelijking op te stellen van de volledige verbranding van diesel.
Diesel kan worden opgeschreven als C14H30.
Om hiervoor een reactievergelijking op te stellen moeten we eerst opschrijven tussen welke stoffen deze reactie gaat plaatsvinden.
Bij verbranding reageert een brandstof met zuurstof, dus we gaan omschrijven dat diesel C14H30 met zuurstof reageert.
Omdat het een volledige verbranding is betekent het dat diesel zal verbranden tot CO2: koolstofdioxide en water H20.
Nu is deze reactievergelijking nog niet kloppend, want we hebben niet evenveel deeltjes aan de linkerkant als aan de rechterkant.
We hebben bijvoorbeeld 14 koolstofatomen hier, maar we hebben hier maar één.
Dus we moeten de coëfficiënten van deze stoffen gaan veranderen om deze reactie kloppend te maken.
Om dit zo overzichtelijk mogelijk te bespreken ga ik even opschrijven welke deeltjes ik voor de pijl heb en hoeveel er ik er na de pijl heb.
We hebben natuurlijk koolstof, waterstof en zuurstof. We hebben C, H en O, en hier hebben we ook C, H en O.
Op dit moment, als je kijkt naar de reactie, zie je dat we hier 14 koolstof hebben, 30 waterstof en 2 zuurstof.
Aan de rechterkant hebben we 1 koolstof en 2 waterstof en 3 zuurstof.
Dus we hebben links 14 koolstofatomen, 30 waterstofatomen en 2 zuurstofatomen en aan de rechterkant hebben we 1 koolstofatoom, 2 waterstofatomen en 3 zuurstofatomen.
Maar waar moet je nou beginnen, begin je nou bij de zuurstof, begin je nou bij de koolstof?
Wat handig is om bij het grootste molecuul te beginnen en dat is diesel.
Die heeft al 14 koolatomen dus we weten nu al wat we dan ook moeten doen, dat we in ieder geval meer koolstofdioxide aan de rechterkant moeten krijgen.
Omdat we 14 koolstofatomen aan de linkerkant hebben moeten er dus 14 koolstofatomen aan de rechterkant komen.
En omdat koolstofdioxide de enige koolstofdrager is, gaan we hier 14 van toevoegen.
Dus dat klopt, als we 14 koolstofdioxide nu gaan hebben betekent dat we ook opeens veel meer zuurstof aan de rechterkant hebben.
Namelijk in plaats van 3 hebben we er nu 28 van de koolstofdioxide en nog 1 van het water.
Dus dat betekent dat we er hier nu 29 hebben.
Nu we onze koolstof kloppend hebben, moeten we nu onze waterstof kloppend maken.
Je zag wel dat we aan de linkerkant 30 waterstofatomen hebben en dat we nu aan de rechterkant er maar 2 hebben.
Dat betekent dat we eigenlijk 30 waterstofatomen aan de rechterkant moet hebben, maar zoals je kan zien 1 molecuul water draagt 2 waterstofatomen.
Dus dat zou betekenen als je er hier in plaats van 2, 30 hebt dat je dus 15 watermoleculen maar nodig hebt.
Maar nu we ons water hebben aangepast en dat 15 watermoleculen hebben betekent het niet alleen dat we ons waterstof hebben aangepast maar ook onze hoeveelheid zuurstof.
We hadden al 28 zuurstofatomen in ons koolstofdioxide zitten, maar nu hebben we daar 15 zuurstofatomen bij gekregen en 28 plus 15 is natuurlijk 43.
We zijn er bijna maar nog niet helemaal.
Aan de rechterkant en weten we nu met hoeveel atomen en moleculen we eindigen, maar zoals je kan zien, we hebben 43 zuurstofatomen aan de rechterkant en we hadden er nog maar 2 op het begin.
Dat betekent dat we onze hoeveelheid zuurstof op het begin wat omhoog moeten krikken.
Als we 43 zuurstofatomen nodig hebben betekent dat dat als we een koppels van 2 doen dat je dus 21,5 zuurstof molecuul nodig hebt.
Nja, misschien denk je nu hallo dat mag helemaal niet en dat klopt ook.
We hebben besloten dat coëfficiënten alleen hele getallen zijn en dat betekent dat halve dus niet kunnen.
Nou denk je misschien dat we nu alles opnieuw moeten doen maar gelukkig is hier een heel handig trucje voor.
We gaan alles gewoon keer twee doen.
Dat betekent dat ons 21.5 nu 43 wordt en dat die andere coëfficiënten ook keer 2 gaan doen.
Dus ik ga even een nieuwe reactievergelijking opschrijven.
Nou, we zijn er denk je misschien, maar wacht. Het is altijd goed om op het einde nog een keer te checken of het wel klopt wat we hebben gedaan.
Want als je nou, stel je hebt ergens een fout gemaakt dan kan je dat later weer corrigeren. Dus we gaan even tellen.
Hoeveel koolstofatomen hebben we voor en na de pijl.
We hebben hier 2 keer 14 koolstofatomen, dat zijn dus 28 koolstofatomen.
En hier hebben we 28 CO2 wat betekent dat we ook 28 koolstofatomen hebben.
Dan kijken we naar ons waterstof.
Aan de rechterkant zien we dat we 60 waterstofatomen hebben en dan aan de linkerkant zien we dat de 2 keer 30 dus ook 60 waterstofatomen aan die kant hebben, dus die kloppen ook.
Laten we kijken of zuurstof klopt.
Aan de linkerkant hebben we 43 keer 2 dus dat is 86 zuurstofatomen.
En aan de rechterkant hebben we 28 keer 2 is 56 zuurstofatomen aan de linkerkant en 30 aan de andere kant. En dat is ook 86.
Pfew, gelukkig. En daarmee hebben we onze reactievergelijking kloppend gemaakt.
Oké, laten we het nog even samenvatten.
Als je wordt gevraagd om een reactievergelijking op te stellen, schrijf dan op met welke stoffen je begint: je beginstoffen, en na de pijl de stoffen die je hebt gevormd: de reactieproducten.
Als er bijvoorbeeld in de vraag staat dat je een volledige verbranding moet opschrijven vergeet dan niet dat dat eindigt in CO2 en in water.
Schrijf dan de atomen op waar deze reactie uit bestaat en ga eens even tellen hoeveel je er aan het begin hebt en hoeveel je eindigt.
Begin dan vervolgens bij het molecuul dat het grootst is en werk naar het molecuul toe met de minste deeltjes, in dit geval was het begonnen we bij diesel en eindigde we toen bij zuurstof.
Als je uiteindelijk je reactie hebt opgesteld en je hebt coëfficiënten met de helft, schrik dan niet maar vermenigvuldig al je coëfficiënten met twee om vervolgens een hele mooie reactievergelijking te maken.
Als je dan uiteindelijk denkt dat je klaar bent ga er dan nog een keer controleren om zeker te zijn dat jij het goede antwoord hebt en succes!
Vond je dit nou interessant en wil je meer weten? Kijk dan onze andere filmpjes over chemisch rekenen op exactwatjezoekt.nl.
Wij zijn Noor, Lotte en Mimi van de Sisters in Science.
Wil je meer van ons zien? Volg ons dan op Instagram op SistersinScience_NL.