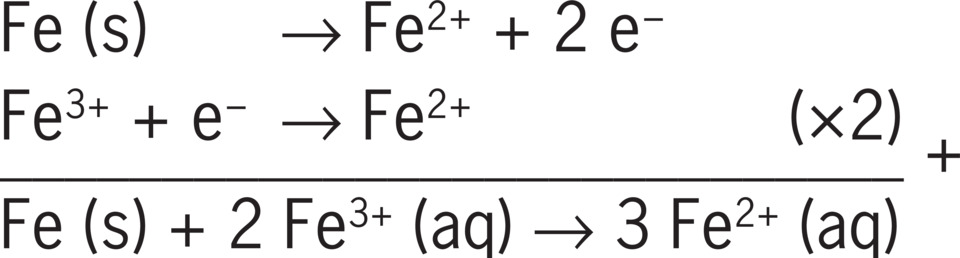Vraagbaak scheikunde
Batterij
Vak
Scheikunde
Niveau
Vwo
Onderwerp
Chemie & technologie
Leerjaar
6
- Dit onderwerp bevat 5 reacties, 2 deelnemers, en is laatst geüpdatet op 1 jaar, 2 maanden geleden door
Tim.
-
AuteurBerichten
-
Tim
GastEr is een elektrochemische cel met twee halfcellen A en B.
In halfcel A met oplossingen van ijzer(III)chloride en ijzer(II) chloride vindt de volgende reactie plaats:Fe3+ + e− → Fe 2+
Leg uit of de elektrode in deze halfcel een positieve of negatieve elektrode is.
Juiste antwoord: positief
Er worden elektronen opgenomen, waardoor de elektrode positief wordt.
Er is een elektrochemische cel met twee halfcellen A en B.
In halfcel A met oplossingen van ijzer(III)chloride en ijzer(II) chloride vindt de volgende reactie plaats:
Fe3++ e− → Fe2+
Deze halfcel is met een zoutbrug met halfcel B verbonden.De zoutbrug bevat een oplossing van natriumchloride.
Geef voor beide ionen in de zoutbrug aan in welke richting ze bewegen.
Juiste antwoord
In de halfcel A verdwijnt positieve lading. Dus de Na+‑ionen bewegen naar A en de Cl−‑ionen bewegen de andere kant op.Er is een elektrochemische cel met twee halfcellen A en B.
In halfcel A met oplossingen van ijzer(III)chloride en ijzer(II) chloride vindt de volgende reactie plaats:
Deze halfcel is met een zoutbrug met halfcel B verbonden.
De zoutbrug bevat een oplossing van natriumchloride.
In halfcel B bevindt zich een ijzeren staaf als elektrode in een keukenzoutoplossing. Op de elektrochemische cel is een lampje aangesloten dat brandt.
Geef de vergelijking voor de reactie in halfcel B en geef ook de vergelijking van de totale reactie.
Juiste antwoord
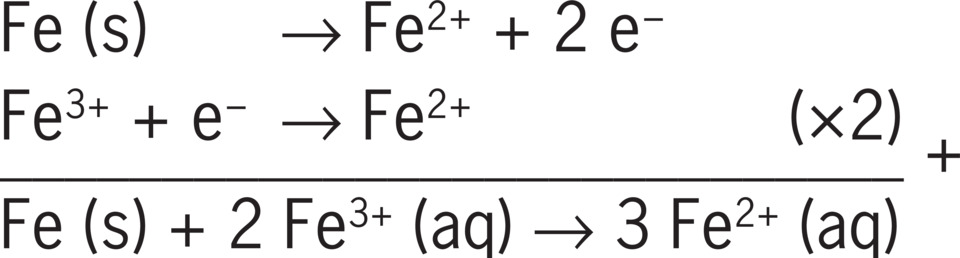
Er is een elektrochemische cel met twee halfcellen A en B.
In halfcel A met oplossingen van ijzer(III)chloride en ijzer(II) chloride vindt de volgende reactie plaats:
Fe3+ + e− → Fe2+Deze halfcel is met een zoutbrug met halfcel B verbonden.
De zoutbrug bevat een oplossing van natriumchloride.
In halfcel B bevindt zich een ijzeren staaf als elektrode in een keukenzoutoplossing. Op de elektrochemische cel is een lampje aangesloten dat brandt.
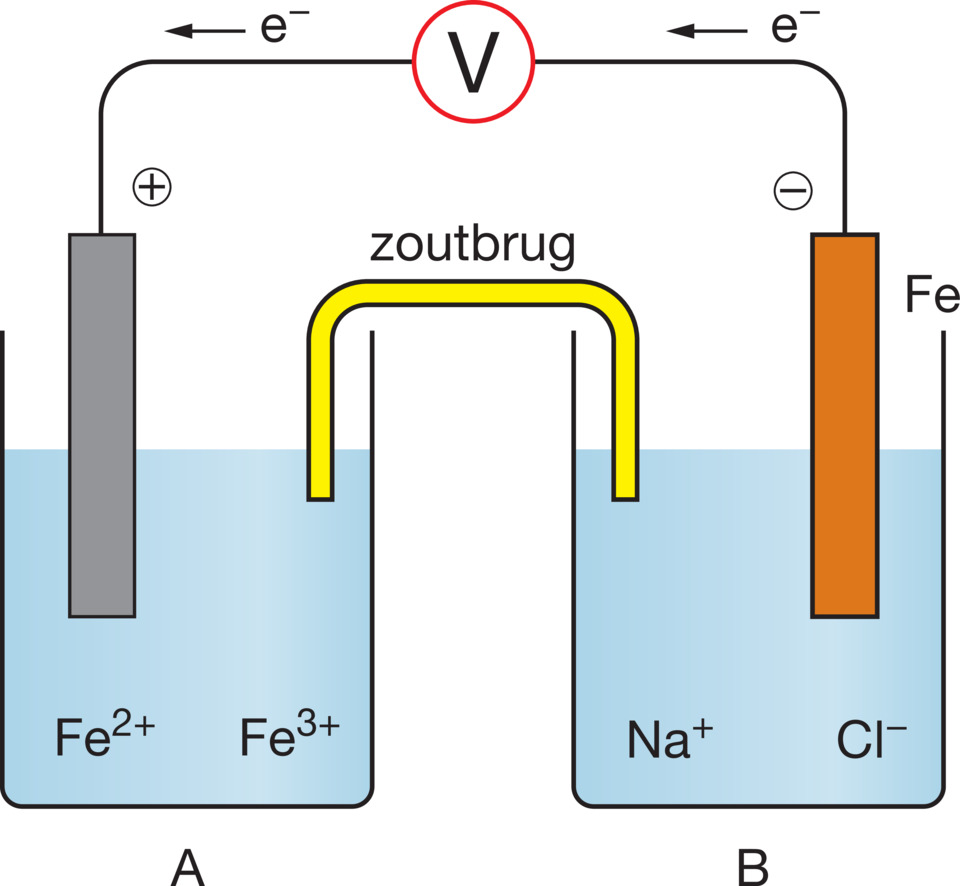
Teken de complete elektrochemische cel. Geef hierin aan wat de positieve en wat de negatieve elektrode is. Geef ook de richting van de elektronenstroom aan.
Juiste antwoord
Zie figuur 18.1.
Er is een elektrochemische cel met twee halfcellen A en B.
In halfcel A met oplossingen van ijzer(III)chloride en ijzer(II) chloride vindt de volgende reactie plaats:
Fe3+ + e− → Fe2+
Deze halfcel is met een zoutbrug met halfcel B verbonden.
De zoutbrug bevat een oplossing van natriumchloride.
In halfcel B bevindt zich een ijzeren staaf als elektrode in een keukenzoutoplossing. Op de elektrochemische cel is een lampje aangesloten dat brandt.Wat is de functie van het natriumchloride in halfcel B?
Juiste antwoord: In halfcel B moet de vloeistof de stroom ook geleiden. Het natriumchloride is hier dus elektrolyt, onderdeel van de zoutbrug.
Er is een elektrochemische cel met twee halfcellen A en B.
In halfcel A met oplossingen van ijzer(III)chloride en ijzer(II) chloride vindt de volgende reactie plaats:
Fe3+ + e− → Fe2+
Deze halfcel is met een zoutbrug met halfcel B verbonden.
De zoutbrug bevat een oplossing van natriumchloride.
In halfcel B bevindt zich een ijzeren staaf als elektrode in een keukenzoutoplossing. Op de elektrochemische cel is een lampje aangesloten dat brandt.Bereken de bronspanning van deze elektrochemische cel.
Juiste antwoord
De bronspanning bij standaardomstandigheden is:
ΔV0 = V0(Fe3+/Fe2+) − V0 (Fe2+/Fe) = 0,77 − (−0,45) = 1,22 VJe wilt de zoutbrug vervangen door een membraan.
Leg uit welke ionen het membraan wel en welke ionen het membraan niet door mag laten.
De oxidator Fe3+ mag niet worden doorgelaten. De reductor is de vaste stof ijzer, dus die komt niet van zijn plaats. Fe2+ kan beter ook worden tegengehouden. Dit ion reageert niet, maar zal naar halfcel A gaan en daar het evenwicht van Fe3+ en Fe2+ongunstig beïnvloeden. Na+‑ionen en Cl−‑ionen mogen er wel door. Na+‑ionen gaan er al naartoe en Cl−‑ionen gaan er niet naartoe omdat dit een overschot aan negatieve lading zou geven.
Dit is een vraag uit mijn boek met de antwoorden. Nu vroeg ik mij af zeg je bij vraag G altijd als een ipv een zoutbrug een membraan plaatst dat niks doorgelaten mag worden muv de ionen uit de zoutbrug?
Tim
GastJe wilt de zoutbrug vervangen door een membraan.
Leg uit welke ionen het membraan wel en welke ionen het membraan niet door mag laten.
De oxidator Fe3+ mag niet worden doorgelaten. De reductor is de vaste stof ijzer, dus die komt niet van zijn plaats. Fe2+ kan beter ook worden tegengehouden. Dit ion reageert niet, maar zal naar halfcel A gaan en daar het evenwicht van Fe3+ en Fe2+ ongunstig beïnvloeden. Na+‑ionen en Cl−‑ionen mogen er wel door. Na+‑ionen gaan er al naartoe en Cl−‑ionen gaan er niet naartoe omdat dit een overschot aan negatieve lading zou geven.<Susanne C3
ExpertTim, Omdat je de vraag kopieert uit je boek, krijg je die rare tekens erbij. Ik ga kijken of ik ze weg kan halen.
Susanne (moderator)
Jan Wim Peters
ExpertHallo Tim,
Wat een hoop tekst. Kon dat niet anders?
Even wat opmerkingen over de opgave.
Volgens het eerste schema wordt er stroom geleverd. Dan moet er geen Voltmeter worden geschakeld(laat geen stroom door), maar een Ampèremeter. En er is geen Cl- getekend in cel A. Verwarrend want daarom denk je dat Cl– alleen in cel B zit.
Je hebt de molariteiten van de reagerende deeltjes nodig om de bronspanning te berekenen. In cel B zit zelfs geen Fe2+ ( niet genoemd in ieder geval) dus niet te berekenen. Of zijn ze allemaal 1 Molair?
Membraan. De Cl– ionen gaan bij stroomlevering van A naar B door het membraan.Kun je hier verder mee?
Groet,
Jan Wim Peters
Jan Wim Peters
ExpertNog even over de laatste vraag: het membraan mag inderdaad alleen ionen doorlaten die niet bij de reacties betrokken zijn. Dat had je dus helemaal bij het juiste eind.
gr. Jan Wim
Tim
GastDan begrijp ik het dankuwel. Als ik nog ooit een vraag heb zal ik minder tekst doen 🙂
-
AuteurBerichten
Bekijk ook eens

Vraag
eiwit

Vraag
eiwitgehalte bepalen met Kjeldahl-methode

Vraag
pH

Vraag
redoxreactie

Vraag
Redox waterstofperoxide

Vraag
Redox waterstofperoxide

Vraag
koolwaterstoffen nummering

Vraag
Redox en groene chemie

Vraag
Chemisch rekenen de molariteit