
Vraagbaak scheikunde
Redox
Vak
Scheikunde
Niveau
Vwo
Onderwerp
Reacties
Leerjaar
5
- Dit onderwerp is leeg.
-
AuteurBerichten
-
nora
Gast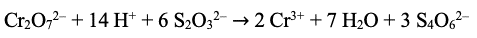
Leg uit welk deeltje reageert als oxidator.
Je kunt het beste kijken naar het metaal chroom in deze reactie. De lading van chroom links vergelijken met de lading van chroom rechts geeft je de informatie die je nodig hebt.
Chroom heeft links van de pijl een lading van 6+, rechts is deze 3+. Heeft dit deeltje dan elektronen opgenomen of afgestaan?
Het chroom-deeltje in Cr2O72- heeft een lading van 6+, na de reactie heeft chroom een lading van 3+, dit kan alleen als het Cr2O72- elektronen heeft opgenomen. Dat deeltje is dan ook de oxidator. Hoe zie je dat de lading links van de pijl 6+ is?
mui
GastDag Nora,
Dat zie je mbv het model met oxidatiegetallen.
Oxidatiegetallen zijn denkbeeldige ladingen van een atoom in een samengesteld deeltje.
Het oxidatiegetal van zuurstof in een molecuul van een verbinding of zoals hier in een samengesteld ion is bijna altijd 2-
In het dichromaation heb je dan 7 zuurstofatomen met oxidatiegetal 2-. Als je rekening houdt met de lading van het dichromaation kom je voor een chroomatoom op 6+ uit.
Mocht je na deze reactie nog vragen hebben, stel ze!
Groet
MUI
-
AuteurBerichten
Bekijk ook eens

Vraag
Zuur-basereacties

Vraag
Aminozuren

Vraag
Meerwaardige zuren en basen

Vraag
zuur-basereacties

Vraag
zuur-basereacties

Vraag
redoxreactie

Vraag
meerwaardig zuur

Vraag
groote proteine poeder





