Het hele PWS is te downloaden helemaal bovenaan de pagina.
Inhoudsopgave
Samenvatting
De katalysatoren die tegenwoordig worden gebruikt bij de productie van waterstof zijn te schaars en te duur voor veel toepassingen. Het is dus belangrijk om nieuwe katalysatoren te ontwikkelen van veel voorkomende metalen. Waterstof is een goede energiedrager die in de toekomst gebruikt kan worden om energie in op te slaan. De mens kan daardoor onafhankelijk worden van fossiele brandstoffen die altijd en overal energie kunnen leveren.
De Universiteit van Amsterdam ontwikkelt en onderzoekt (ijzer)katalysatoren die een deel van de waterstofproductie kunnen katalyseren. Wij hebben de invloed van de samenstelling van de oplossing (soort buffer en pH) op de effectiviteit van een (ijzer)katalysatorcomplex onderzocht. De hoogste TON en TOF vonden wij bij een acetaatbuffer bij een pH van 6. Hieruit kunnen wij de conclusie trekken dat het door ons onderzochte (ijzer)katalysatorcomplex beter werkt bij een pH hoger dan 4,5. We hebben het (ijzer)katalysatorcomplex niet kunnen onderzoeken bij een pH hoger dan 6. De hoogste TON en TOF kunnen dus bij een hogere pH liggen.
Het onderzoek was voor ons leerzaam. Tijdens het werk aan ons experiment in het lab van de UvA hebben wij veel praktische ervaring opgedaan. Daarnaast hebben we van dhr. Hessels ook veel geleerd over de theorie achter dit onderwerp. Na de uitleg van dhr. Hessels hebben wij deels zelfstandig gewerkt. Dat beviel ons erg goed. Het werken in het lab van de UvA heeft ons ook een goede indruk gegeven van aspecten van het werk van onze experts.
Inleiding
De zonneparken en windmolenparken worden tegenwoordig uit de grond gestampt. Halen we zo het klimaatakkoord van Parijs? Het antwoord is nee. Het klimaatakkoord van Parijs heeft als doel: de opwarming van de aarde beperken tot maximaal 2 ℃ en bij voorkeur 1,5 ℃. Naast het akkoord van Parijs won op 24 juni 2015 Urgenda, samen met 900 mede-eisers, de klimaatzaak tegen de Nederlandse Staat. De rechter droeg de Staat op om de uitstoot van broeikasgassen in 2020 met 25% te verminderen ten opzichte van 1990. De Staat moet de burgers beschermen tegen de gevolgen van de klimaatverandering, daarom moet Nederland de uitstoot van broeikasgassen terugdringen met tenminste 25% ten opzichte van 1990.
Het Planbureau voor de Leefomgeving (PBL) meldde in januari 2019 dat het Urgenda-doel niet bereikt zal worden. De uitspraak stelt dat de Staat meer moet doen tegen de uitstoot van broeikasgassen. Er moet nog 9 megaton CO2 bespaard worden om de reductie van 25% broeikasgassen ten opzichte van 1990 te halen. Er wordt gedacht aan het sluiten van de kolencentrales en/of het verlagen van de maximumsnelheid van 130 km/h naar 120 km/h of zelfs naar 100 km/h.
Het sluiten van de kolencentrales in Nederland wordt door veel mensen als een slecht idee gezien. We hebben namelijk 3 nieuwe, moderne kolencentrales, die relatief weinig uitstoten. Als wij in Nederland de kolencentrales sluiten, dan moeten we bij weinig zon en wind onze energie uit het buitenland importeren. Die energie komt dan bijvoorbeeld uit Oost-Europese kolencentrales, die wellicht lang niet zo efficiënt zijn als de Nederlandse kolencentrales.
We kunnen in Nederland overstappen op energie van de zon en de wind, maar er is één groot probleem. Het waait niet altijd en de zon schijnt niet altijd. We moeten de energie dus op de een of andere manier opslaan. Waterstof is een van de meest energierijke stoffen die we kennen. Waterstof kan worden geproduceerd uit water, dat overal op aarde te vinden is. Daarnaast kan waterstof door middel van een brandstofcel omgezet worden in elektrische energie wanneer er energie nodig is. Waterstof kan worden geproduceerd als er veel duurzame energie beschikbaar is. Bij het produceren van waterstof en het omzetten van waterstof in energie worden tegenwoordig edelmetalen gebruikt als katalysator. Katalysatoren van edelmetalen hebben vaak een hoge TON en TOF. De TON (turn over number) is het aantal omzettingen die een katalysator kan katalyseren. De TOF (turn over frequency) is het aantal omzettingen die de katalysator per tijdseenheid kan katalyseren. Edelmetalen als katalysator gaan dus lang mee en werken snel.
Men weet echter niet of er bijvoorbeeld genoeg platinum is om een substantieel deel van auto’s in de Verenigde Staten te voorzien van brandstofcellen met platinum katalysatoren27. Met in het achterhoofd verantwoorde consumptie en productie (doelstelling 12 van de duurzame ontwikkelingsdoelstellingen van de VN) moeten we het gebruik van schaarse metalen zo veel mogelijk beperken. Ook al werken de tegenwoordige edelmetaal katalysatoren lang en goed.
Er wordt daarom onderzoek gedaan om metalen die veel voorkomen, zoals bijvoorbeeld ijzer, te gebruiken als katalysatoren om waterstof te produceren. Onder andere de Universiteit van Amsterdam ontwikkelt dit soort katalysatoren. De katalysatoren zijn op dit moment nog verre van optimaal, maar het onderzoek naar de katalysatoren geeft inzicht in de werking van deze alternatieve katalysatoren. Deze inzichten kunnen worden gebruikt om nieuwe, betere en efficiëntere katalysatoren te ontwikkelen.
Die katalysatoren zorgen er wellicht ooit voor dat wij geen kolencentrales meer nodig hebben om, in tijden van weinig wind en zon, voldoende energie te hebben. We hebben dan wellicht een energienet dat op ‘pure duurzame energie’ werkt.
De Universiteit van Amsterdam ontwikkelt en onderzoekt katalysatoren. Zij hebben ons de opdracht gegeven om onderzoek te doen naar de TON en TOF bij verschillende pH-waarden van een door hun ontwikkeld (ijzer)katalysatorcomplex. Het (ijzer)katalysatorcomplex van de Universiteit van Amsterdam is een OER, een ‘oxygen evolution reaction’ katalysator. Dat is een katalysator die water omzet in zuurstof. Het (ijzer)katalysatorcomplex is op dit moment alleen getest bij een pH van 4,5 in een acetaatbuffer. Het (ijzer)katalysatorcomplex is afgeleid van een katalysator uit de literatuur. De katalysator uit de literatuur gaf de beste TON van de onderzochte katalysatoren in dat onderzoek.
Onderzoeksvraag
Wanneer zijn de TON en TOF van het (ijzer)katalysatorcomplex van de universiteit van Amsterdam maximaal als functie van de samenstelling van de bufferoplossing?
De samenstelling van de bufferoplossing is onder andere de concentratie H3O+ en de soort buffer, bijvoorbeeld een fosfaatbuffer of een acetaatbuffer.
We hebben daarbij de volgende deelvragen die helpen bij de beantwoording van de onderzoeksvraag.
1. Is de TON en TOF van het (ijzer)katalysatorcomplex afhankelijk van de soort buffer?
2. Heeft de pH van de buffer invloed op de TON en TOF van het (ijzer)katalysatorcomplex?
3. Komt de optimum pH (TON en TOF zijn maximaal) van het (ijzer)katalysatorcomplex overeen met de optimum pH van de literatuur katalysator?
De deelvragen dragen bij aan de beantwoording van de hoofdvraag. Om de maximale TON en TOF van het (ijzer)katalysatorcomplex te vinden, moeten wij eerst onderzoeken wat de invloed is van de soort buffer (1) en de pH (2) op de TON en TOF. Daarna worden die resultaten vergeleken met de resultaten van de literatuur katalysator (3). Dit geeft inzicht in de overeenkomsten of verschillen tussen de literatuurkatalysator en het (ijzer)katalysatorcomplex.
Het antwoord op de onderzoeksvraag geeft inzicht in de kwaliteit van de katalysator. Met die informatie kan de katalysator ook vergeleken worden met bestaande edelmetaal katalysatoren. Het antwoord op de onderzoeksvraag en de deelvragen kan ook inzicht geven hoe de katalysator werkt.
Literatuuronderzoek
Om een bruikbare hypothese te schrijven moet er eerst naar de literatuur worden gekeken om voorspellingen te doen over de invloed van de buffer en pH op de katalysator.
Literatuur over ‘basis’ katalysator
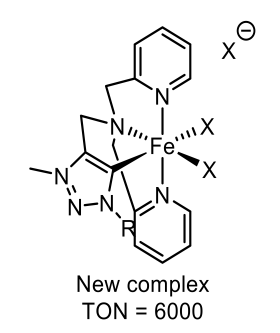
Het (ijzer)katalysatorcomplex van de Universiteit van Amsterdam (Fig. 3.2) dat onderzocht wordt, is gebaseerd op een andere katalysator. Die ‘basis’ katalysator (Fig. 3.1) heeft de basis gevormd voor het ontwikkelen van de katalysator die onderzocht wordt. De ‘basis’ katalysator heeft een relatief vergelijkbare structuur met de UvA katalysator, daarom lijkt het ons nuttig om belangrijke informatie over de ‘basis’ katalysator te bekijken.
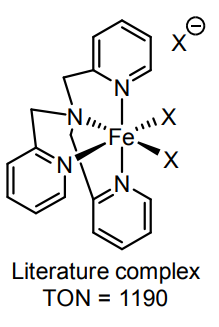
Figuur 3.1. IJzercomplex literatuur

Figuur 3.2. IJzercomplex van drs. Joeri Hessels (UvA)
In het onderzoek ‘An efficiënt oxygen evolving catalyst based on a µ-O diiron coordination complex’ 2 worden een aantal katalysatoren met elkaar vergeleken. Ze gebruiken een acetaat buffer (molariteit = 0,23M, pH = 4,5), 10mM Oxone en 0,75µM katalysator bij de beste activiteit van de ‘basis’ buffer.
De beste activiteit was bij een TON van 2380 (1190 als het complex als twee helften wordt gezien) en een TOF van 2,2 s-1 (1,1 s-1).
De complexen vallen na ca. 2380 omzettingen uit elkaar. De metaalgroep komt dan terug in de vormen, zoals Fe2O3, Fe, Fe(OH)3, etc.
De acetaat buffer in combinatie met Oxone leidde tot zeer weinig zuurstof productie. Ook het mengsel van een acetaat buffer met Oxone en Fe2O3 / FeCl3 leidde tot zeer weinig zuurstof productie.
In het onderzoek hebben zij een katalysator (katalysator 1 in literatuur) opgelost in een acetaat buffer2. Met de hulp van UV/VIS-spectroscopie hebben ze een bruine ijzer dimeer gevonden (Fe – O – Fe)2. Een dimeer is een chemische verbinding die uit twee monomeren bestaat. Een dimeer wordt bij elkaar gehouden door covalente of intermoleculaire bindingen17. Als de ‘basis’ katalysator in een acetaat buffer wordt toegevoegd, dan vormt zich [(TPA)2Fe2(µ-O) (µ-OAc)]3+. Bij het oplossen in een ‘Britton–Robinson’ buffer of in water wordt dat complex niet gevormd. Deze Fe-O-Fe binding in dat complex lijkt de katalytische werking te veroorzaken. Bij het oplossen van zowel FeTPA (1) en [(TPA)2Fe2(µ-O)Cl2]2+ (2) (85 in figuur 3.3) werd
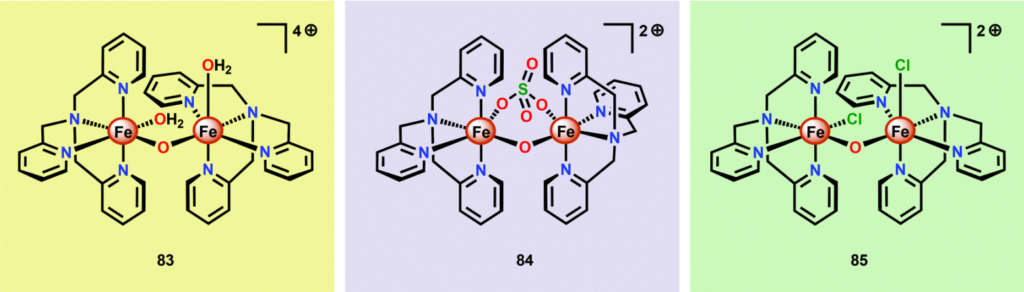
Figuur 3.3. Structuren van dimeer Fe complexen [(tpa)(OH2)Fe(μ-O)Fe(OH2)(tpa)]4+ (83), [(tpa)Fe(μ-O)(μSO4)Fe(tpa)]2+ (84) and [(tpa)(Cl)Fe(μ-O)Fe (Cl)(tpa)]2+ (85) uit bron 3
waarschijnlijk [(TPA)2Fe2(µ-O)(µ-OAc)]3+ gevormd. Bij een titratie met NaOH van de acetaat buffer met daarin (katalysator 1 uit literatuur), gaf een pH = 4,5 de hoogste TON. Bij een pH van 3,5 en 5,5 was de TON kleiner. Ook de absorptie van specifieke punten in het spectrum die waarschijnlijk wordt veroorzaakt door [(TPA)2Fe2(µ-O)(µ-OAc)]3+ waren hoger bij een pH van 4,5.
Men gaat ervan uit dat de Fe-O-Fe dimeer instabiel wordt door protonen.
Hypothese
Wij verwachten een hogere TON en TOF bij een hogere pH. We hebben daarvoor een aantal redenen.
- Stabiliteit van de Fe-O-Fe: De katalysator van de Universiteit van Amsterdam is gebaseerd op een katalysator uit de literatuur (1.3.3. Literatuur over ‘basis’ katalysator). De katalysator van UvA heeft net als de literatuur katalysator een Fe-groep en werkt ook bij een pH van 4,5. De hoogste TON die tot nu toe is gemeten met de katalysator van UvA is ca. 6000. Dit is een stuk hoger, dan de TON gemeten bij de literatuur katalysatoren. Als we ervan uitgaan dat bij de
katalysator van UvA ook een Fe-O-Fe dimeer ontstaat, dan is de katalyse pH afhankelijk. In de literatuur denkt men namelijk dat de Fe-O-Fe instabiel wordt door zuur. Het Fe-O-Fe dimeer wordt gezien als de veroorzaker van de katalytische werking. Het volledige complex uit de literatuur was het stabielst bij een pH van 4,5. Er werden op dat moment de meeste Fe-O-Fe bindingen gevonden. Bij een hogere en lagere pH werd het aantal van de Fe-O-Fe bindingen minder. Dit zou betekenen dat het complex van UvA ook het beste werkt bij een pH van 4,5. - Het enige zover bekende verschil tussen het literatuurcomplex en de katalysator van de UvA is voornamelijk het chelaat. Het chelaat van de UvA heeft in plaats van een pyridine achtige groep, een ring met 3 stikstofatomen. Stikstofatomen met 3 bindingen hebben normaal één vrij elektronenpaar. Een vrij elektronenpaar betekent over het algemeen dat het atoom nucleofiel is. Het wil dus bijvoorbeeld graag een proton hebben. Bij een lagere pH zullen de stikstofatomen van de katalysator van de UvA sneller een proton binden, omdat er dan meer protonen in de oplossing aanwezig zijn. Op het moment van het binden van een proton ontstaat er een positieve formele lading bij het N-atoom. Er bestaat dan een verhoogde kans dat het complex uit elkaar valt, omdat de positieve lading zich dan vooral aan de binnenkant van het complex bevindt. Dit is zichtbaar op figuur 4.1.
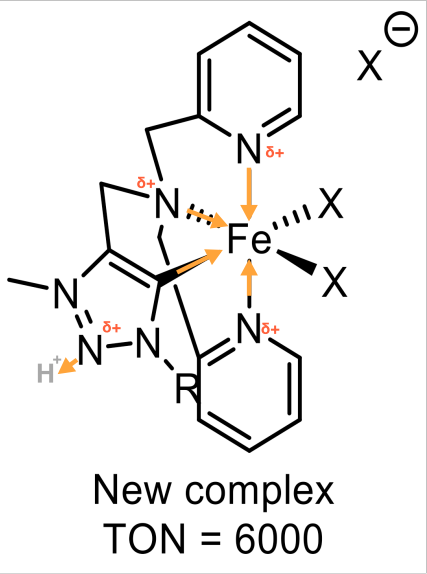
Figuur 4.1. IJzercomplex van drs. Joeri Hessels met aantekeningen over de ladingen
Uit de redenering hierboven blijkt dat ten eerste de optimum pH van het complex ongeveer 4,5 zal zijn. Verder staat er dat er groepen aanwezig zijn die onder invloed van een lage pH het uit elkaar vallen van het complex kunnen veroorzaken.
Reactie
In het reactievat is aanwezig 200mM Oxone, een buffer van een bepaalde pH en 10 µM katalysator. De vergelijking van de reactie die optreedt in het reactievat is hieronder weergegeven.
Oplosvergelijking Oxone: 2KHSO5 ⋅ KHSO4 ⋅ K2SO4 ⟶ 2HSO− 5 + HSO− 4 + SO2− 4 + 5K+
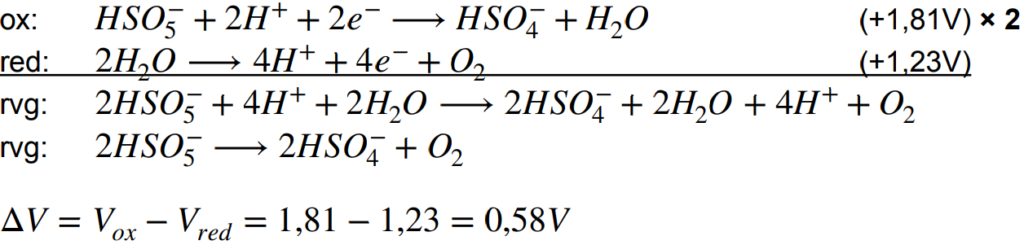
We vinden hier een ΔV van 0,58V. Dat betekent dat we hier spreken van een aflopende reactie. Een aflopende reactie wil niet zeggen dat er geen evenwicht is. Het wil zeggen dat het evenwicht ver naar rechts ligt, dus richting het vormen van 2HSO− 4 + O2.
De reactiesnelheid van de reactie om op deze manier O2 te maken is erg laag, daarom wordt er gebruik gemaakt van een katalysator. De katalysator verandert de evenwichtsconstante niet, maar verhoogt de reactiesnelheid.
Dat valt ook te zien aan de grafieken uit het literatuuronderzoek (An efficient oxygen evolving catalyst based on a l-O diiron coordination complex†). Zij hebben een acetaatbuffer met Oxone laten reageren. De opbrengst na dezelfde periode was echter veel lager, dan de opbrengst met de katalysator.
Conclusie
De TON en TOF van het (ijzer)katalysatorcomplex zullen dus waarschijnlijk pH afhankelijk zijn. De soort buffer zal waarschijnlijk ook invloed hebben op de TON en TOF. De optimum pH van de literatuurkatalysator zal waarschijnlijk anders zijn, dan de optimum pH van het (ijzer)katalysatorcomplex, vanwege de veranderingen in het chelaat.
We verwachten een maximale TON en TOF bij een pH van iets hoger dan 4,5. Bij een pH boven 7 verloopt de reactie waarschijnlijk slechter, omdat er dan een stuk minder H+ aanwezig is om het Oxone als oxidator te laten werken.
De reactiesnelheid zal op een bepaald moment sterk afnemen als de katalysator op is.
Benodigdheden
Experiment
- Acetaatbuffer
- Fosfaatbuffer
- Katalysator
- Oxone
- pH-meter
- Druk-meter
- Microbalans – Spatel
- Weegschaal – Magnetische roerboon
- Flacons van 2 mL, 5 mL en 10 mL
- Micropipetten van 100–1000 µl en 10-100 µl
- Pipet
- Computer voor de gegevens
- Reactievat
- Ultrasoon reiniger
- Handschoenen
- Labjas
- Veiligheidsbril
- Verwijderaar voor magnetische
mengstaafjes
Schoonmaak
- HCl 1M
- NaOH 5 M
- Aceton
- Spuitfles demiwater
- Bekerglas
- Zuurkast
- Papier
Buffer
- K2HPO4 zout, KH2PO4 zout, CH3COOH
- oplossing – Spuitfles demiwater
- Bekerglazen
- pH-meter
- Papier
Methode
Om de onderzoeksvraag te beantwoorden en de hypothese te verifiëren of te falsifiëren worden er doormiddel van de volgende werkwijze bewijzen verzameld. Bij het experiment wordt gebruik gemaakt van een reactievat (Fig. 6.1). De beginstoffen worden allemaal toegevoegd aan het reactievat. Op het reactievat wordt een druksensor gedraaid. Bij de reactie ontstaat O2(g). Het gas gaat uit de oplossing, omdat het reactievat is afgesloten, loopt de druk op. De druktoename wordt gemeten. De druktoename is om te rekenen naar het aantal mol O2 dat gevormd is.

Figuur 6.1. Reactievat
In tabel 6.1. zijn de variabelen vermeld. Bij een onafhankelijke variabele spreken we van de variabele die gevarieerd wordt, bij een afhankelijke
variabele spreken we van een gemeten variabele en bij een controle variabele spreken we van variabele die constant blijven.
Tabel 6.1. Variabelen in het experiment

De afhankelijke variabele die onder ‘ΔDruk’ staan vermeld worden berekend door middel van de ΔDruk en de controle variabelen. De berekening voor die waarden is hieronder uitgewerkt.
Voor het berekenen van het aantal mol O2 wordt gebruik gemaakt van de algemene gasconstante en algemene gaswet. De algemene gaswet is de volgende: pV = nRT , waarin p is de druk, V is het volume, n is het aantal mol, R is de gasconstante en T de absolute temperatuur van het gas.
Dit levert de volgende formule n = ![]() . Het aantal mol O2 kan dus berekend worden met deze formule. Bij dit experiment zijn de waarden: V = 15,500 ml, R = 83,144598 cm3 barK−1 mol −1, T wordt gemeten en Δp = p(t) − Pbegin.
. Het aantal mol O2 kan dus berekend worden met deze formule. Bij dit experiment zijn de waarden: V = 15,500 ml, R = 83,144598 cm3 barK−1 mol −1, T wordt gemeten en Δp = p(t) − Pbegin.
De yield wordt berekend door Yield = ![]() . Dit is het aantal mol O2 dat ontstaan is, delen door het maximale aantal O2 dat kan ontstaan (beperkende factor is de hoeveelheid oxidator aanwezig). Het maximale aantal mol O2 dat kan ontstaan is te berekenen uit het aantal mol aanwezige oxidator (Oxone).
. Dit is het aantal mol O2 dat ontstaan is, delen door het maximale aantal O2 dat kan ontstaan (beperkende factor is de hoeveelheid oxidator aanwezig). Het maximale aantal mol O2 dat kan ontstaan is te berekenen uit het aantal mol aanwezige oxidator (Oxone). ![]() . De TON wordt berekend door het aantal mol O2 gedeeld door aantal mol katalysator. De TOF wordt bepaald door de plek te nemen waar de steilheid van de (TON, tijd (min))-diagram het hoogst is.
. De TON wordt berekend door het aantal mol O2 gedeeld door aantal mol katalysator. De TOF wordt bepaald door de plek te nemen waar de steilheid van de (TON, tijd (min))-diagram het hoogst is.
Meetserie
Om de hypothese aan te tonen, moeten we bij een pH < 4,5 een lagere TON vinden en tussen pH 4,5 en 7 een optimum. Een voor de hand liggende meetserie zou dan zijn pH = 3, pH = 4,5 (voorheen al getest, controle proef), pH = 6, pH = 7,5 en pH = 9.
Een acetaatbuffer werkt het beste bij een pH van 3,7 tot 5,7. Dat is kleiner dan de voor de hand liggende meetserie. We hebben daarom gekozen om een fosfaatbuffer te gebruiken, omdat daarmee een buffer met een pH van 6,2 tot 8,2 kan worden gemaakt.
We hebben de fosfaatbuffer bij een pH van 4,5 geprobeerd, om dit te kunnen vergelijken met de acetaatbuffer bij een pH van 4,5. Er trad echter geen tot bijna geen reactie op bij de fosfaatbuffer.
We hebben daarom het onderzoek voortgezet met een acetaatbuffer. We hebben uiteindelijk metingen gedaan bij pH = 3, pH = 4, pH = 5 en pH = 6.
Werkwijze experiment
Bij het uitvoeren van het experiment hebben wij een vaste volgorde gehandhaafd om de herhaalbaarheid en validiteit van het onderzoek te waarborgen.
- Verzamel alle benodigdheden.
- Begin met het maken van een buffer.
- Werkwijze om pH bufferoplossing te maken.
- Maak de pH meter schoon met demiwater en droog hem voorzichtig af.
- Voeg het zuur en de geconjugeerde base met een pipet toe aan een 10mL flacon. – Mix deze oplossingen met een pipet en meet de pH door middel van de pH meter erin te zetten.
- Als men de pH hoger wil, voeg dan meer geconjugeerde base toe. Als men een lagere pH, wil voeg, dan meer zuur toe. Bij de UvA werd gebruik gemaakt van twee bekerglazen waarvan een met pH = 3 en de andere met pH = 8.
- Mix opnieuw en meet de pH.
- Herhaal vorige stap totdat men op de gewenste pH uitkomt.
- Maak de pH meter schoon met demi water en doe hem terug in de standaard oplossing.
- Weeg de juiste hoeveelheid Oxone af en los de Oxone op met buffer, die men toevoegt met een micropipet. Het volume buffer dat moet worden toegevoegd, wordt berekend volgens het blad in de bijlage (Bijlage 1: Format resultaten en berekeningen experiment).
- Weeg ook de juiste hoeveelheid katalysator af en los de katalysator op met buffer, die men toevoegt met een micropipet. Het volume buffer dat moet worden toegevoegd, komt net als hierboven uit de berekening van bijlage 1.
- Zorg dat de bovenstaande oplossingen goed oplossen. Indien dat niet gebeurt, doe de oplossing in de ultrasoonreiniger. Als de oplossing dan nog niet oplost kan men de vermenigvuldigingsfactor op de bijlage veranderen. – Uit de berekeningen van de bijlage blijkt ook de hoeveelheid van de katalysatorbufferoplossing en de oxonebufferoplossing die aan de eindoplossing moeten worden toegevoegd met de micropipet. In totaliteit moet de oplossing in het reactievat 5,00 ml zijn.
- Voeg eerst de berekende hoeveelheid oxonebufferoplossing toe met een micropipet.
- Voeg een magnetische roerder toe aan het reactievat.
- Voeg extra buffer oplossing toe om de oplossing in het reactievat op het einde in totaal 5,00 ml te maken. De hoeveelheid buffer die moet worden toegevoegd = 5,00 ml – hoeveelheid oxonebufferoplossing
- Hoeveelheid katalysatorbufferoplossing.
- Voeg als laatste de katalysatorbufferoplossing toe. De reactie zal nu beginnen. Draai daarom nu ook meteen de drukmeter op het reactievat.
- Nu zet men de computer aan. De computer begint met meten. Dit duurt gemiddeld 30 minuten. De computer wordt stopgezet als de druk toename constant blijft.
- Als het experiment gestopt is, dan moet er worden opgeruimd. Het reactievat wordt met ‘1.5.3. Werkwijze om schoon te maken’ schoongemaakt. De rest van de voorwerpen worden weggegooid of in de vaatwasser gestopt.
Werkwijze om schoon te maken
- Spoel het voorwerp af/door met demiwater. Voer deze stap 2 keer uit.
- Spoel het voorwerp af/door met de 5M NaOH oplossing. Voer deze stap 2 keer uit.
- Spoel het voorwerp af/door met 1M HCL. Voer deze stap 2 keer uit. Het voorwerp bevat nu geen base meer.
- Spoel het voorwerp af met demiwater. Voer deze stap 2 keer uit. We willen natuurlijk geen demiwater op het voorwerp, dat kan namelijk de proef beïnvloeden.
- Droog het voorwerp met papier.
- Spoel het voorwerp nu af met 2 keer aceton. Droog het voorwerp nog een keer af met papier.
- Het voorwerp is steriel.
Resultaten
Voor uitgebreide resultaten en opmerkingen bij de experimenten, zie bijlages 2 en 4. We hebben 6 experimenten uitgevoerd.
Het eerste experiment is uitgevoerd met een fosfaatbuffer. Dat gaf een TON en TOF van 0.
Het tweede experiment werd uitgevoerd met een acetaatbuffer met pH = 2,96. Er vond geen tot bijna geen omzetting plaats. Na het experiment werd de pH van de oplossing in het reactievat gemeten. De pH bleek toen 1,89.
Het derde experiment vond plaats met een acetaatbuffer met pH = 6,04. Bij dit experiment leek de katalysator niet goed op te lossen. Er werd een TON gemeten van ongeveer 2,7 ⋅ 10^3 en een TOF van 3,7 ⋅ 10^2. De pH meting na de reactie van de oplossing in het reactievat gaf een pH van 4,9.
Het vierde experiment vond plaats met een acetaatbuffer met pH = 5,02. Bij dit experiment is er veel zuurstof weggelekt uit het reactievat, omdat de drukmeter niet optimaal vastzat. Er werd een TON gemeten van ongeveer 1,7 ⋅ 10^3 en een TOF van 2,2 ⋅ 10^2.
Het vijfde experiment vond plaats met een acetaatbuffer met pH = 4,04. Er werd een TON gemeten van ongeveer 3,2 ⋅ 10^2 en een TOF van 9.
Het zesde experiment vond plaats met een acetaatbuffer met pH = 5,95. Dit is een herhaling en controle van het derde experiment. Er werd een TON gemeten van ongeveer 3,0 ⋅ 10^3 en een TOF van 4,0 ⋅ 10^2. Bij dit experiment hebben wij de hoogste TON en TOF gemeten.
In figuur 7.1 is de gemeten TON tegen de pH van de experimenten uitgezet. In figuur 7.2 is de TOF tegen de pH van de experimenten uitgezet
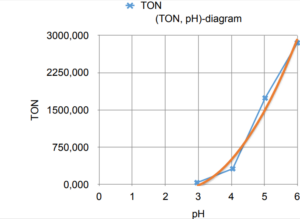
Figuur 7.1. (TON, pH)-diagram
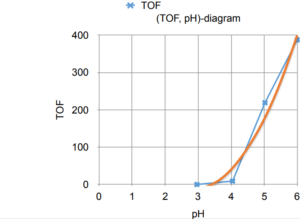
Figuur 7.2. (TOF, pH)-diagram
Discussie
Foutenanalyse
In deze foutenanalyse nemen we experimenten 1 en 2 niet mee. De gemiddelde TON is bij die experimenten namelijk 0. Er is geen significante druktoename gemeten. Bij de data van de experimenten 1 en 2 zijn wel uitschieters, maar die zijn toe te schrijven aan de meetonnauwkeurigheid van de drukmeter.
Meetonnauwkeurigheden
De in tabel 8.1 weergegeven afwijkingen van het aantal mol O2 zijn alleen gebaseerd op meetfouten van gebruikte apparatuur de drukmeter, de temperatuursensor en de micropipetten.
Tabel 8.1. Afwijkingen van het aantal mol O2

De gegevens van tabel 8.1 zijn afkomstig uit de tabellen 3.4.1.2, 3.4.2.2, 3.4.3.2 en 3.4.4.2 in de bijlage. Daar is tevens een onderbouwing gegeven van de afwijking.
De in tabel 8.2 weergegeven afwijkingen van de TON zijn alleen gebaseerd op meetfouten van gebruikte apparatuur de drukmeter, de temperatuursensor, de micropipetten, de microbalans en eventuele onopgeloste deeltjes katalysator in de flacon.
Tabel 8.2. Afwijkingen van TON

De gegevens van tabel 8.2 zijn afkomstig uit de tabellen 3.4.1.1, 3.4.2.1, 3.4.3.1 en 3.4.4.1 in de bijlage. Daar is tevens een onderbouwing gegeven van de afwijking.
De yield is de enige variabele die wordt berekend met de hulp van de afgewogen hoeveelheid Oxone. We schatten een meetonnauwkeurigheid van de massa Oxone op 0,002 g, vanwege de weegschaal en eventueel onopgeloste deeltjes Oxone in de flacon. De gegevens van tabel 8.3 zijn afkomstig uit de tabellen 3.4.1.3, 3.4.2.3, 3.4.3.3. en 3.4.4.3 in de bijlage. De gegevens van 8.3 zijn gebaseerd op de meetfouten van de drukmeter, de temperatuursensor, de micropipetten en de hierboven beschreven afwijking van de massa Oxone.
Tabel 8.3. Afwijkingen van yield

Een ander belangrijk punt is dat bij elke pH die we hebben getest achteraf de pH 1 hele waarde lager was dan voorafgaande aan de test, dit is dus ook belangrijk om in het achterhoofd te houden bij het beoordelen van de resultaten. De TON en TOF zouden dus hoger kunnen uitvallen als de buffer een betere bufferende werking zou hebben, dat betekent dat de buffer zijn pH beter vasthoudt.
De pH van de bufferoplossing die niet in contact is geweest met de reactie bleek na experiment 2 een andere pH te hebben dan oorspronkelijk gemeten. De pH was met 0,38 verhoogd. Dit kan veroorzaakt zijn door de meetonnauwkeurigheid van de pH-meter.
Bij experiment 4 was de dop niet goed vastgedraaid op het reactievat, waardoor er veel zuurstof weglekte. Bij de experimenten 3 en 6 lekte ook zuurstof weg, maar wel minder. Bij experimenten 1, 2 en 5 is het niet vast te stellen of er zuurstof weggelekt is. Er kan waarschijnlijk een hogere TON zijn dan gemeten bij experiment 3, 4 en 6.
De TOF wordt bepaald uit de grafieken van de TON tegen de tijd. Dat geeft een extra kleine afwijking aan de gegevens van TOF.
Er worden een aantal aannames gemaakt bij het bereken van het aantal mol O2. De aannames zijn dat de algemene gaswet altijd geldt en dat de druk geen invloed heeft op het aantal opgeloste zuurstof in de oplossing.
De laatste aanname hebben wij onderzocht op correctheid. Als we uitgaan van een druktoename van 1 bar tot 1,06 bar (de druktoename is bij 3 van de 6 experimenten hoger dan 1,06 bar), dan kan er 2,5 mg extra O2 worden opgelost in water (zie bijlage 3.1 voor berekening).
Dat betekent aantal extra mmol O2 = (2,5mg )/(32 g/mol) = 0,078 mmol. Dit aantal mol kan extra oplossen in de oplossing. Een deel van de zuurstof die bij een reactie ontstaat, kan dus in de oplossing blijven.
Het aantal mol O2 dat extra opgelost kan worden in de bufferoplossing zal echter nog hoger liggen bij de experimenten, waarbij een druk van bijna 0,15 bar (experimenten 3 en 6) werd bereikt. Dit kan uiteindelijk een significant verschil geven. Het verschil is zeker significant bij bijvoorbeeld experiment 4 bij een pH van 5, daarbij was het aantal O2 ontstaan gelijk aan 0,086 mmol en de einddruk was +0,124 bar. Bij het doorrekenen van de extra mol O2 kan dit significante afwijkingen geven. Het aantal mol dat extra opgelost kan worden is namelijk groter dan het aantal mol O2 dat men oorspronkelijk berekend heeft dat ontstaan is bij de reactie.
De afwijkingen van de buffer, de extra opgeloste zuurstof en het experiment waarbij de dop niet goed was bevestigd, zijn belangrijk om in het achterhoofd te houden bij het beoordelen van de meetresultaten.
Beperkingen
We hebben het ijzer-katalysatorcomplex niet kunnen testen bij pH-waarden van hoger dan 6. Een azijnzuur buffer werkt optimaal bij een pH tussen 3,7 tot 5,7. We hebben daarom een fosfaatbuffer buffer geprobeerd. In het mengsel met katalysator, fosfaatbuffer (pH = 4,5) en Oxone ontstond geen zuurstof (geen significante hoeveelheid). In hetzelfde mengsel met een azijnzuurbuffer in plaats van een fosfaatbuffer ontstaat wel zuurstof. Uit het literatuuronderzoek blijkt dat de acetaat wellicht deel uit maakt van de katalysator 2,3. De acetaat gaat werken als een stuk tussen twee Fegroepen. Bij de fosfaatbuffer lijkt de binding met de Fe-groepen niet te gebeuren. Het kan ook zijn dat de fosfaatbuffer bij een pH van 4,5 niet kan binden met de Fe-groepen, maar wel bij een andere pH.
Analyse
Bij experiment 3 en 6 hebben wij een bruine heldere oplossing gekregen bij een pH van ongeveer 6. We hebben het experiment twee maal uitgevoerd bij die pH en beide keren kregen we die bruine kleur. In het literatuuronderzoek heeft men ook een bruine oplossing gevonden. De bruine kleur kan betekenen dat in de oplossing bij een pH van 6 veel van het dimeer (Fe-O-Fe) aanwezig is, dat dimeer geeft namelijk de bruine kleur2. In het onderzoek over de literatuurkatalysator werd gevonden dat als de meeste Fe-O-Fe bindingen aanwezig waren, dat de TON ook het hoogste was. De Fe-O-Fe binding wordt geassocieerd met de katalytische functionaliteit van de complexen. Het vinden van de bruine kleur bij de experimenten met de hoogste TON bij de katalysator kan wijzen op de aanwezigheid van Fe-O-Fe bindingen. Dit hoeft natuurlijk niet zo te zijn, want gehydrateerd Fe3+ in water geeft ook een bruin/gele kleur 15.
De verwachting (hypothese) komt overeen met de resultaten die uit het onderzoek zijn gekomen. Wij verwachtten namelijk dat bij een hogere pH (pH > 4,5) de TON en TOF ook hoger zouden zijn, dat bleek ook zo te zijn. We verwachtten de hoogste pH tussen pH = 4,5 en pH = 7. Dit onderzoek ondersteunt die hypothese, maar als we extrapoleren bij figuur 11, dan kan de TON wellicht nog hoger zijn bij een pH boven 6 of zelfs 7.
In de hypothese hebben we gesteld dat het complex bij hogere pH stabieler zal zijn en beter zal werken. De Fe-O-Fe binding was namelijk minder stabiel bij een lage pH. De resultaten wijzen op een stabieler Fe-O-Fe binding bij een hogere pH, maar dat hoeft niet zo te zijn. Er zijn geen aanwijzingen die iets zeggen over de lagere stabiliteit van het chelaat van de katalysator bij een lagere pH. Het chelaat van de katalysator heeft echter wel invloed op optimum pH van het katalysator, want we vinden een andere optimum pH, dan er werd gevonden bij de literatuurkatalysator. In het chelaat bevindt zich namelijk het enige verschil met de literatuurkatalysator.
De resultaten van dit onderzoek roepen natuurlijk nieuwe vragen op. Een nieuwe onderzoeksvraag zou bijvoorbeeld kunnen zijn: “Waarom werkt deze katalysator beter bij een hogere pH?”, “Werkt de katalysator nog beter bij een nog hogere pH?”, “Hoe ontstaat de bruine kleur bij de experimenten en wat voor invloed heeft dit op de resultaten?” Door het beantwoorden van onze onderzoeksvraag en de vragen die daaruit voortkomen komt men dichter bij het ontwikkelen van betere alternatieve katalysatoren. Die nieuwe alternatieve katalysatoren van veelvoorkomende metalen, zoals bijvoorbeeld ijzer, kunnen wellicht in de nabije toekomst gaan concurreren met edelmetaal katalysatoren. Dan kan men die katalysatoren betaalbaar toepassen in bijvoorbeeld brandstofcellen of fabrieken die waterstof produceren. In de inleiding werd al genoemd dat we de klimaatdoelen niet zullen halen door alleen gebruik te maken van zonnepanelen en windmolens. Het opslaan van energie zal nodig zijn om over te kunnen stappen op ‘pure duurzame energie’. Het opslaan van die energie kan dan bijvoorbeeld met waterstof met de hulp van katalysatoren waar dit onderzoek een bijdrage aan heeft geleverd.
De voornaamste beperking van ons onderzoek is dat wij de katalysator niet hebben kunnen testen bij een pH hoger dan 6. Wij gaan er wel van uit dat de TON en TOF bij hogere pH-waarden nog hoger zullen zijn. Als we extrapoleren in figuren 7.1 en 7.2 zouden we namelijk kunnen aannemen, dat de TON en TOF bij een hogere pH in een acetaatbuffer nog hoger uitvallen, misschien zelfs boven een pH van 7.
Aanbevelingen
- Het testen van de katalysator bij hogere pH’s (pH > 7) om de hypothese gesteld in dit onderzoek beter te kunnen beantwoorden.
- Onderzoek naar de oorzaak van de bruine kleur bij experimenten 3 en 6. Wordt de bruine kleur daadwerkelijk veroorzaakt door een dimeer of niet?
- Het onderzoeken van een fosfaatbuffer bij hogere pH’s in combinatie met het ijzerkatalysatorcomplex.
Conclusie
We hebben als hypothese gesteld dat bij een pH tussen 4,5 en ongeveer 7 een hogere TON en TOF kunnen vinden, dan bij een pH van 4,5.
Uit de resultaten zien we een afname van zowel de TON als de TOF als de pH afneemt. De pH heeft dus invloed op de TON en TOF van de katalysator. Uit experiment 1 blijkt dat de soort buffer waarschijnlijk ook invloed heeft op de TON en TOF van de katalysator. De fosfaatbuffer leek namelijk niet te werken bij een pH van 4,5. De hoogste TON en TOF werden gevonden bij een pH van 6 (de hoogst gemeten pH in dit onderzoek) in een acetaatbuffer. De hoogste TON was 3,0·10³ (pH = 6, acetaatbuffer). De hoogste TOF (min) was 405, dus 6,8 per seconde, bij (pH = 6, acetaatbuffer). De optimum pH van de katalysator komt niet overeen met de optimum pH van literatuurkatalysator, daarvan was de optimum pH namelijk 4,5 2.
De hypothese kan maar deels als waar worden aangenomen. Het complex is getest bij verschillende pH waarden in een acetaatbuffer, maar niet boven 6. De optimum pH kan dus bij een hogere pH liggen.
Bronnen
De onderstaande bronnen bestaan uit onderzoeken over (ijzer)katalysatoren en katalysatoren in het algemeen. Een aantal bronnen (onder andere wikipedia) hebben wij gebruikt om de vaktaal in onderzoeken te begrijpen.
1. Flynn, G. (2003). Enzyme kinetics. Wiley Encyclopedia of Chemical Biology, 6(2), 1–11. https:// doi.org/10.1002/9783527806461
2. Liu, Y., Xiang, R., Du, X., Ding, Y., & Ma, B. (2014). An efficient oxygen evolving catalyst based on a µ-O diiron coordination complex. Chemical Communications, 50(84), 12779–12782. https://doi.org/10.1039/c4cc04118f
3. Kärkäs, M. D., & Åkermark, B. (2016). Water oxidation using earth-abundant transition metal catalysts: Opportunities and challenges. Dalton Transactions, 45(37), 14421–14461. https:// doi.org/10.1039/c6dt00809g
4. Berkey, M. (2014, 27 april). Coordination Chemistry – Transition Metal (Ion) Complexes [Video]. Geraadpleegd van https://www.youtube.com/watch?v=tyG5K9OcaDw
5. Calmes, J., Bernt, S., Prasad, S., Chebrolu, S., Virani, A., & Khim, J. (z.d.). Coordinate Bonds | Brilliant Math & Science Wiki. Geraadpleegd van https://brilliant.org/wiki/coordinate-bonds/
6. complex ions – acidity of the aqua ions. (z.d.). Geraadpleegd van https://www.chemguide.co.uk/inorganic/complexions/acidity.html
7. expondo.nl. (z.d.). Geraadpleegd van https://www.expondo.nl/broedmachines/?p=1
8. Libretexts. (2018a, 26 november). Ligands. Geraadpleegd van https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Supplemental_Modules_(Inorganic_Chemistry)/Coordination_Chemistry/Properties_of_Coordination_Compounds/Ligands
9. Libretexts. (2018b, 26 november). 9.5: Lewis Acids and Bases. Geraadpleegd op 28 januari 2019, van https://chem.libretexts.org/Bookshelves/General_Chemistry/Book%3A_Chem1_(Lower)/10._Acids_and_Bases/9.5%3A_Lewis_Acids_and_Bases
10. Wikipedia contributors. (z.d.). Induced fit diagram- Wikipedia. Geraadpleegd op van https://en.wikipedia.org/wiki/File:Induced_fit_diagram.png
11. Wikipedia contributors. (2019a, 28 januari). Energy profile (chemistry) – Wikipedia. Geraadpleegd van https://en.wikipedia.org/wiki/Energy_profile_(chemistry)
12. Wikipedia contributors. (2019b, 27 januari). biological molecule. Geraadpleegd van https://en.wikipedia.org/wiki/Enzyme
13. Wikipedia contributors. (2019c, 28 januari). Molecule of high relative molecular mass, the structure of which essentially comprises the multiple repetition of units derived, actually or conceptually, from molecules of low relative molecular mass. Geraadpleegd van https://en.wikipedia.org/wiki/Macromolecule
14. Wikipedia contributors. (2019d, 28 januari). Domain of chemistry beyond that of molecules that focuses on the chemical systems made up of a discrete number of assembled molecular subunits or components. Geraadpleegd van https://en.wikipedia.org/wiki/Supramolecular_chemistry
15. Wikipedia contributors. (2019e, 28 januari). Coordination complex. Geraadpleegd van https://en.wikipedia.org/wiki/Coordination_complex
16. Wikipedia contributors. (2019f, 28 januari). Coordinate covalent bond – Wikipedia. Geraadpleegd van https://en.wikipedia.org/wiki/Coordinate_covalent_bond
17. Wikipedia contributors. (2019g, 27 januari). Dimer (chemistry). Geraadpleegd van https://en.wikipedia.org/wiki/Dimer_(chemistry)
18. Wikipedia-bijdragers. (2018a, 28 december). Enzymatische katalyse – Wikipedia. Geraadpleegd van https://nl.wikipedia.org/wiki/Enzymatische_katalyse
19. Wikipedia-bijdragers. (2018b, 26 oktober). Supramoleculaire chemie. Geraadpleegd van
https://nl.wikipedia.org/wiki/Supramoleculaire_chemie
20. Wikipedia-bijdragers. (2018c, 30 november). Coördinatieverbinding. Geraadpleegd van https://nl.wikipedia.org/wiki/Co%C3%B6rdinatieverbinding
21. Wikipedia-bijdragers. (2018d, 6 oktober). Buffer (scheikunde). Geraadpleegd van https://nl.wikipedia.org/wiki/Buffer_(scheikunde)
22. Wikipedia-bijdragers. (2019a, 7 januari). Chelatie. Geraadpleegd van https://nl.wikipedia.org/wiki/Chelatie
23. Wikipedia-bijdragers. (2019b, 7 januari). Ligand. Geraadpleegd van https://nl.wikipedia.org/wiki/Ligand
24. Wikipedia-bijdragers. (2019c, 9 januari). Gasconstante. Geraadpleegd van https://nl.wikipedia.org/wiki/Gasconstante
25. Wikipedia-bijdragers. (2019d, 12 januari). Algemene gaswet. Geraadpleegd van https://nl.wikipedia.org/wiki/Algemene_gaswet
26. Wikipedia-bijdragers. (2019e, 26 januari). Zichtbaar spectrum. Geraadpleegd van https://nl.wikipedia.org/wiki/Zichtbaar_spectrum
27. Arges, C. B. G., Ramani, V., & Pintauro, P. N. (2010). The Chalkboard: Anion Exchange Membrane Fuel Cells. Interface, 31–35. https://doi.org/10.1149/2.f03102if













