Vraagbaak scheikunde
Titratie PO Hulp Gezocht
Vak
Scheikunde
Niveau
Vwo
Onderwerp
Reacties
Leerjaar
5
- Dit onderwerp bevat 19 reacties, 1 deelnemer, en is laatst geüpdatet op 7 maanden, 3 weken geleden door
mui.
-
AuteurBerichten
-
EINSTEIN2.0
GastHallo scheikundige experts,
Ik zit in 5 vwo en heb pas een po over titratie gemaakt en moet hierbij een verslag schrijven.
In de methode van het onderzoekblad stond dit:
- Pipetteer 10,0 ml ammoniumsulfaat oplossing (AS opl) van ongeveer 8 g/L in een erlenmeyer van 250 ml.
- Voeg hieraan toe met pipet 25,0 ml 0,10 M natronloog (NaOH opl). Vul aan tot ongeveer 100 ml met gedemineraliseerd water.
- Kook de oplossing na toevoeging van 4 kooksteentjes/glasparels tot er geen ammoniak meer ontsnapt. Dit duurt een minuut of 8. Controleer dit door een klein stukje nat gemaakt rood lakmoespapiertje, m.b.v. een pincet, in de damp te houden. Waarnemingen?
- Koel af, voeg enkele druppels indicator (methylrood of fenolftaleïne; kies zelf de juiste!) toe.
- Titreer met 0,05M zwavelzuur (zit al in de buret).
De onderzoeksvraag is:
Wat is het gehalte ammoniumsulfaat in g/L in een ammoniumsulfaat-oplossing?
Ik zit alleen met de reactie vergelijkingen tussen de basen en de zuren. Dit lukt me niet.
Ik heb zelf al wat geprobeerd en kwam op het volgende uit:
(NH4)2SO4 + OH -> (NH3)2SO4 + H2O
Na het verdampen van NH3 en het titreren met HCL heb ik dit:
SO4 + 2H3O -> H2SO4 + 2H2O
Mijn vraag is: klopt dit? en zo niet: wat is er fout?
MVG,
Een hulpzoekende student
Wim Wessel
ExpertHallo Einstein2.0,
Ik zie dat je herkend hebt dat het ammoniumion in ammoniumsulfaat het zuur is, dat met de base uit natronloog moet reageren. Je reactievergelijking moet wel aangepast worden. Kijk onder andere steeds goed of je te maken hebt met een zout of een moleculaire stof.
1. Ammoniumsulfaat is een zout, dus in oplossing heb je alleen losse ammonium- en sulfaationen.
2. Het ammoniumion reageert met de base in natronloog (de lading van het hydroxide-ion ontbreekt nog); je hebt goed gezien dat hierbij ammoniak ontstaat, maar dat is een moleculaire stof en bindt zich niet aan de sulfaationen; de sulfaationen zijn in deze reactie tribune-ionen (en schrijf je dus niet op).
3. In de tweede vergelijking heb je de goede reagerende deeltjes voor de pijl staan, hoewel de ladingen ook hier ontbreken. Echter, het sulfaation kan in oplossing slechts één H+ ion opnemen. Daarmee ontstaat dan het waterstofsulfaation: HSO4–. In Binas tabel 49 kan je zien dat dit het zuurrestion van een sterk zuur ofwel een zeer zwakke base is. Dit betekent dat dit ion in water te zwak is om nog een H+ ion op te nemen.
N.B.: je moet je titratie uitvoeren met zwavelzuur maar je schrijft HCL. Aangezien zowel zwavelzuur als HCl sterke zuren zijn, maakt dat gelukkig voor je notatie niets uit.
Je was al aardig ver gekomen. Ik hoop dat je hiermee verder kunt. Laat het me weten als je nog andere vragen hebt.
Groeten,
Wim Wessel
EINSTEIN2.0
GastGoedenavond meneer Wessel,
Ten eerste: bedankt voor het antwoord en mijn excuses voor het verwisselen van HCL en H2SO4.
Het klinkt misschien een beetje dom, maar ik begrijp het nog niet helemaal. Kunt u misschien de reactievergelijkingen geven?
Ik hoor graag meer! Bedankt alvast!
MVG
Wim Wessel
ExpertHallo Einstein2.0,
Ik wil je helpen de reactievergelijkingen op te stellen, maar daarvoor wil ik weten welk(e) stukje(s) je niet (helemaal) begrijpt. Kan je concreet aanwijzen welk stukje uitleg ik nog moet toelichten?
Groeten,
Wim Wessel
EINSTEIN2.0
GastBeste meneer,
Ik heb nu deze reactievergelijkingen: 2NH4+ 2OH– → 2NH3 + 2H2O en
SO4-2 + H3O+ → HSO4– + H2O
Zijn deze goed?
Wim Wessel
ExpertHallo Einstein2.0,
Dat ziet er heel goed uit. Nog twee verbeterpunten: ik mis de lading van het ammoniumion en de eerste vergelijking moet je nog vereenvoudigen, dus alle coëfficiënten delen door 2. Dit laatste maakt voor je berekening niets uit, maar op een examen kost het niet vereenvoudigen je een punt (beetje zonde, toch 😉 ). Verder heb je alles goed !
Groeten,
Wim Wessel
EINSTEIN2.0
GastBeste meneer,
Allereerst: enorm bedankt voor uw hulp!
Ik heb echter nog een vraag, namelijk: bij stap 2 van de methode(zie vraag) staat er dit:
- Voeg hieraan toe met pipet 25,0 ml 0,10 M natronloog (NaOH opl). Vul aan tot ongeveer 100 ml met gedemineraliseerd water.
Moet ik dan die 65 ml erbij rekenen met het uit rekenen?
Ik heb namelijk nu dit:
Door het aantal g/l ammoniumsulfaat in een ammoniumsulfaat oplossing te berekenen ga je als volgt te werk. De reactievergelijkingen zijn als volgt. Bij stap 2 krijgen we deze reactievergelijking:
NH4+ + OH– → NH3 + H2O. Na het verdampen van NH3 bij stap 3 krijgen en het titreren met zwavelzuur (HCL) krijgen we de volgende reactievergelijking:
SO4-2 + H3O+ → HSO4– + H2O
Er zijn vooraf een aantal dingen gegeven:
NaOH:
v = 25 mL = 0,025 L
c = 0,09969 M. Deze was gegeven op het bord.
(NH4)2SO4:
v = 10,0 mL = 0,0100 L
= 8 g/L
H2SO4
c = 0,04973 M. Ook deze was gegeven op het bord.
v = afhankelijk welke meting je gebruikt.
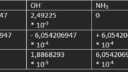
Eerst gaan we het aantal mol (NH3)2SO4– berekenen.
We hebben 10,0 ml en 8 g/l ammoniumsulfaat. deze formule kunnen we gebruiken om m te berekenen. Je krijgt dan m = * v. Invullen van 0,0100 l bij v en 8g/l bij geeft m = 0,08 g
Om vervolgens de n te berekenen gebruik je n = m / M. De m = 0,08 g en de M = 132,13952 g / mol.
Invullen geeft n = 6,054206947 * 10-4 mol.
Het aantal mol van NaOH berekenen we als volgt: we gebruiken de formule n = c * v. Voor de c hebben wij 0,09969 M gebruikt en voor de v hebben wij 0,025 L gebruikt. n = 0,00249225 mol.
Vervolgens hebben wij een boe-tabel gebruikt om het aantal mol SO4– te berekenen.

Het aantal mol (NH3)2SO4– is dus: 6,054206947 * 10-4 mol.
Doordat het ammoniak (NH3) nu verdampt is krijgen wij nu deze reactievergelijking: SO4-2 + H3O+ → HSO4– + H2O.
We gaan nu het aantal mol HCL berekenen. Dit doen we door n = c * v te gebruikten. Bij de c doen wij 0,04973 M en bij de v gebruiken wij het aantal ml bij meting 1. 14,60 mL = 0,01460 L. Invullen geeft
n = 7,26058 * 10-4 mol.
Ook nu gebruiken wij een boe-tabel om het aantal mol HSO4– te berekenen.
We hebben nu het aantal mol HSO4–. Hoe moeten wij nu verder? weet u dat?
Ik snap dat dit erg verwarrend is. Als u geen tijd/zin hebt om deze te beantwoorden begrijp ik dat! Ik zou het echter graag waarderen. Morgen als u tijd heeft is het ook goed. Maakt u zich alstublieft niet druk! Er staan nog hier en daar wat foutjes in. Deze ga ik nog aanpassen.
MVG,
EINSTEIN2.0
Wim Wessel
ExpertHallo Einstein2.0,
Volgens mij klopt je berekening. Je formule van ammoniumsulfaat klopt echter (nog steeds) niet, maar ik denk dat je een tabelwaarde voor de molaire massa hebt gebruikt, dus je komt ermee weg 😉 .
Jouw laatste stap is echter niet logisch: waarom wil je het aantal mol HSO4– weten? Kijk naar je onderzoeksvraag: het gehalte ammoniumsulfaat in de oplossing. Dus het lijkt me beter om het aantal mol gereageerde SO42- te berekenen. Als je dat weet, weet je daarna direct het aantal mol (NH4)2SO4 , waar de sulfaationen uit kwamen.
Om je antwoord af te ronden moet je nog twee dingen doen. Je onderzoeksvraag vraagt om een gehalte in g/ L. Je moet dus het aantal mol omrekenen in het aantal gram. Het tweede is: in welk volume zat dit aantal mol (NH4)2SO4? Dat moet je nog omrekenen naar de hoeveelheid per liter.
Succes.
Groeten,
Wim Wessel
EINSTEIN2.0
GastBeste meneer,
U bedoeldt dus dat wij die laatste boe-tabel niet hoefde te maken, als ik het goed begrijp?
zo ja: wat hebben we dan aan die 2e reactievergelijking?
En wat is er nog verkeerd aan de ammoniumsulfaat formule?
Ik kom misschien dom over, maar ik begrijp het gewoon echt niet. Sorry daarvoor.
mvg
P.S. nogmaals bedankt voor uw inzet!
Wim Wessel
ExpertHallo Einstein2.0,
Ik heb de formule van ammoniumsulfaat is mijn laatste reactie genoemd. Vergelijk die eens met wat je zelf hebt geschreven.
Ik werd door een collega op een denkfout gewezen, die ik even over het hoofd heb gezien. Sorry daarvoor.
Je titratie is een terugtitratie. Ik neem aan dat je weet wat dat is. Je hebt een overmaat aan natronloog toegevoegd aan je ammoniumsulfaatoplossing. Na die eerste reactie is er dus nog OH– over. Die titreer je met de zwavelzuur: H3O+ + OH– –> 2 H2O.
Je weet hoeveel zwavelzuur je hebt toegevoegd, dus dan weet je hoeveel OH– er over was.
Je weet hoeveel OH– je totaal hebt gepipetteerd, dus dan weet je hoeveel OH– er met ammonium weggereageerd is.
Daarmee weet je tenslotte met hoeveel NH4+ de OH– heeft gereageerd. Je moet die hoeveelheid nog wel omrekenen naar g/ L. Je kunt deze stappen ook in een BOE tabel uitwerken.
Ik hoop dat je er hiermee uit komt.
Groeten,
Wim Wessel
EINSTEIN2.0
GastGoedemiddag meneer Wessel,
Ik ben weer even bezig geweest en als ik het goed begrijp bedoelt u dit:
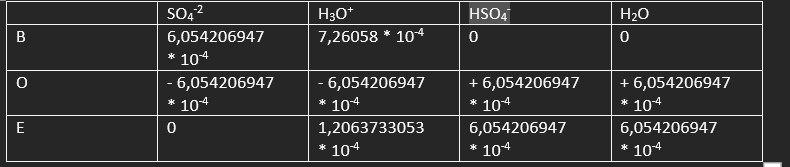
na deze reactievergelijking: NH4+ + OH– → NH3 + H2O hou je OH– over. Het aantal mol OH– bij de eerste vergelijking is (zie boe tabel vorige reactie) 1,8868293 * 10-3 mol. Dit aantal mol reageert dan weer met zwavelzuur en dat geeft deze reactievergelijking: H3O+ + OH– –> 2 H2O.
Het totaal aantal mol OH– was 2,49225 * 10-3 mol.
Wat we overhielden in de eerste vergelijking is: 1,8868293 * 10-3 mol.
Nu kunnen wij het aantal mol gebruikte H3O+ berekenen. De verhouding tussen H3O+ en OH– is 1:1 dus het aantal mol OH– is het aantal mol H3O+ is dus 1,8868293 * 10-3 mol. Dit is het aantal mol dat gebruikt is in de 2e reactie vergelijking. Het totale aantal mol H3O+ is dus n = c * v . Bij de c doen wij 0,04973 M en bij de v gebruiken wij het aantal ml bij meting 1. 14,60 mL = 0,01460 L. Invullen geeft n = 7,26058 * 10-4 mol. Het aantal mol H3O+ dat gereageerd heeft met SO4-2 is dus: 7,26058 * 10-4 – 1,8868293 * 10-3 = -1.1607713 * 10-3 mol.
Maar dit kan niet, want we houden als het goed is H3O+ over en nu staat dat in de min.
Weet u hoe dit kan of hebben wij gewoon verkeerd getitreerd?
MVG,
EINSTEIN2.0
Gast{toevoeging}
NH4+ + OH– → NH3 + H2O (+OH–(overmaat)) . Vervolgens verdampt de NH3 en hou je H2O (+OH–) over. Dat reageert weer met H3O+ en krijg je: H3O+ + OH– -> 2H2O. OH– is nu weg. Je kan nu dus uitrekenen hoeveel H3O+ er nog over is wat vervolgens weer reageert met SO4-2 in deze vergelijking: SO4-2 + H3O+ → HSO4– + H2O
Dit is wat er gebeurd toch?
Wim Wessel
ExpertHallo Einstein2.0,
Het probleem zit in het begrijpen van je opdracht. Je hebt een oplossing gekregen met ongeveer 8 g/ L ammoniumsulfaat en jouw opdracht is om het gehalte d.m.v. een titratie precies te bepalen. Het getal van 8 g/ L is dus onzeker en daarmee kan je je berekening niet starten, wat jij wel gedaan hebt.
Bij een titratieberekening begin je meestal met je meetgegevens: het gemeten volume en de gegeven molariteit, dus bij jou de 14,60 mL en 0,04973 M. Kijk uit dat de molariteit van de zwavelzuur is, niet van de H3O+. Zwavelzuur is een tweewaardig zuur (= kan 2 H+ ionen per molecuul afstaan), dus voor H3O+ moet je rekenen met een molariteit van 2 * 0,04973 = 0,09946 M.
Volgens de formule n = c * v heb je dus 14,60·10-3 * 0,09946 = 1,452·10-3 mol H3O+ gebruikt bij de titratie. Je zag dat de molverhouding H3O+ : OH– 1 : 1 is, dus er was 1,452·10-3 mol OH– over.
Jij had al berekend dat er 2,492·10-3 mol OH– totaal was toegevoegd, dus voor de eerste reactie is (2,492 – 1,452)·10-3 = 1,040·10-3 mol OH– verbruikt. In de eerste reactie is de molverhouding NH4+ : OH– 1 : 1 , dus in jouw erlenmeyer zat 1,040·10-3 mol NH4+ (dus hoeveel mol ammoniumsulfaat?). Deze hoeveelheid zat in de 10 mL, die je hebt gepipetteerd.
Jij moet dan alleen nog de chemische hoeveelheid omrekenen naar de massa en die massa (per 10 mL) naar een massa per liter. Ik heb het alvast doorgerekend en ik denk dat je een knappe uitvoering hebt gedaan.
Groeten,
Wim Wessel
EINSTEIN2.0
GastGoedemiddag,
Bedankt voor uw hulp en uw reactie opnieuw.
Door wat te rekenen kwam ik dus op dit uit:
1,040·10-3 mol NH4+ . De stof waar het uit komt is (NH4)2SO4. Het aantal mol moet dus * 2 geeft 0,00208 mol. m = n* M en voor de M nemen wij 132,14 geeft n = 0,2748512 g.
ρ = m / v. Voor v vullen wij in 10 ml geeft 0,02748512 g / 10 ml * 100 = 2,7 g/L. Dit is toch niet ongeveer 8 g/L🤨. En is de uiteindelijke oplossing niet basisch?
MVG,
einstein2.0
Wim Wessel
ExpertHallo Einstein2.0,
Je maakt in je haast twee foutjes:
1. één mol ammoniumsulfaat levert 2 mol NH4+, dus van je moet het aantal mol NH4+ delen door 2 om het aantal mol ammoniumsulfaat te krijgen;
2. bij de omrekening naar het aantal liter is je massa opeens 10x kleiner.
Als je op deze twee punten corrigeert, zou je op 6,9 g/ L moeten uitkomen. Ik vind dat niet zo’n slechte uitkomst voor deze hele proef.
Groeten,
Wim Wessel
-
AuteurBerichten
Bekijk ook eens

Vraag
fasen van stoffen in een reactievergelijking

Leertip
10 tips om uitlegvideo’s effectief te gebruiken

Vraag
Zuren en basen

Vraag
azijnzuur en zuur-base

Vraag
Uitleg vraag 22 van scheikunde examen 2023 eerste tijdvak.

Vraag
Zuur-Base en redox

Vraag
Halfreacties

Vraag
Zuren en basen

Vraag
hydrofiel of hydrofoob?