
Vraagbaak scheikunde
Molariteit berekenen uit de geleidbaarheid?
Vak
Scheikunde
Niveau
Vwo
Onderwerp
Chemisch rekenen
Leerjaar
5
- Dit onderwerp bevat 27 reacties, 2 deelnemers, en is laatst geüpdatet op 1 jaar, 1 maand geleden door
docent Dick.
-
AuteurBerichten
-
Jaap
GastGoedeavond,
Ik heb een vraagje over een opdracht die ik moet uitvoeren voor mijn practicum verslag. In mijn practicum heb ik eerst de stroomsterkte moeten meten van een oplossing kalkwater waar co2 ingeleid wordt. Vervolgens de stroomsterkte van een oplossing natronloog waar zwavelzuur aan toe wordt gevoegd. Nu is de opdracht om de molariteit van de onderzochte natronloog te berekenen. De molariteit van de gebruikte zwavelzuur is gegeven en voor de rest weet ik de volgende gegevens:
– Equivalentiepunt van proef 2 (natronloog waar zwavelzuur aan toe wordt gevoegd)
– 25 mL natronloog (hoeveel water erbij is niet bekend)
– Ook heb ik een grafiek van het verloop van proef 1 (kalkwater waar co2 in wordt geleid)
het zou kunnen dat ik gegevens over het hoofd zie.Wat trouwens proef 1 met proef 2 te maken heeft blijft mij onbekend.
Kunnen jullie mij helpen met het berekenen van de molariteit van de onderzochte natronloog?
Mvg, Jaap
docent Dick
ExpertBeste Jaap,
Ik begrijp het volgende:
– je hebt waarschijnlijk de geleidbaarheid gemeten van een kalkwateroplossing waarin CO2 werd geleid.
– daarna de geleidbaarheid gemeten bij een titratie van een zwavelzuuroplossing met natronloog.
Bij deze proef heb je vermoedelijk een grafiek gemaakt: geleidbaarheid uitgezet tegen het aantal ml toegevoegde natronloog. Uit deze grafiek kun je het eindpunt van de titratie bepalen.
Lukt dat?
Je weet met hoeveel ml zwavelzuuroplossing van een bekende Molariteit je bent begonnen.
Kun je uitrekenen hoeveel (m)mol zwavelzuur je in het begin had?
Bij het eindpunt van de titratie geldt: (m)mol H3O+ = (m)mol OH–
Als je weet na hoeveel ml natronloog toevoegen het eindpunt van de titratie was., kun je nu uitrekenen wat de molariteit van de natronloog was.
Er is volgens mij geen direct verband tussen proef 1 en proef 2.
Wel kun je zien dat de grafieken van de beide proeven niet dezelfde vorm hebben.
Kom je er nu uit?
Zo niet, deel dan even al je gegevens en stel je vervolgvraag.
Groeten,
Dick
Jaap
GastBeste Dick,
Ik heb inderdaad de geleidbaarheid gemeten van eerst een oplossing van kalkwater waar CO2 in geleid werd en vervolgens van een oplossing van natronloog waar zwavelzuur aan toegevoegd werd.
De grafiek van de natronloog-zwavelzuurproef ziet eruit in de vorm van:
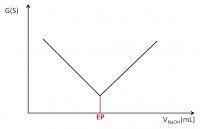
Hier is dus uit te halen wat het equivalentie punt is, maar hoe haal ik hier dan de molariteit van natronloog uit?
Mvg, Jaap
docent Dick
ExpertBeste Jaap,
Prima, goede grafiek.
Stel dat je 25,0 mL 0,200 M zwavelzuur had.
25,0 * 0,200 * 2 mmol H3O+ = 10,0 mmol H3O+
Stel eindpunt van de titratie na toevoegen van 15,5 ml natronloog
10,0 mmol H3O+ = 10,0 mmol OH–
Molariteit natronloog: 10,0 mmol/15,5 mL = 0,645
Is de aanpak je nu duidelijk?
Zo nee, dan zie ik je vervolgvraag wel weer.
Jaap
GastBeste Dick,
Kunt u mij uitleggen waarom de concentratie H3O+ en OH- op het equivalentiepunt gelijk zijn?
En nog een vraagje in uw voorbeeld is de eenheid van de molariteit toch mmol/ml dus ook wel mol/l (wat het gebruikelijke is).
Mvg, Frederique Roele
docent Dick
ExpertBeste Jaap,
In het equivalentiepunt (of eindpunt van de titratie): heeft alle H3O+ reageert met OH–. Vandaar dat ik aangeef:
Als de oplossing 10,0 mmol H3O+ bevatte, heb je 10,0 mmol OH– moeten toevoegen om het eindpunt van de titratie te bereiken.
Bij het eindpunt van de titratie is er geen zuur meer.
Bij het eindpunt van de titratie van een sterk zuur (zwavelzuur) met een sterke base ( natronloog) is de pH dan 7,0.
Voor je de titratie begon bevatte de opl. H3O+ , SO42-, H2O.
Tijdens de titratie daalt de hoeveelheid H3O+ en komt er Na+ in de oplossing doordat je Na+ en OH– toevoegt.
In het eindpunt van de titratie bevat de oplossing Na+(aq) en SO42-(aq) en H2O
Ik hoop dat ik je vragen goed heb beantwoord.
Molariteit is inderdaad mmol/mL of mol/L
Groeten,
Dick
Jaap
GastBeste Dick,
ik begrijp hem nu denk ik. Echter wordt er zwavelzuur aan natronloog toegevoegd en niet andersom, maar dit maakt voor de rest geen verschil uit. Ik ga het nu proberen uit te rekenen met mijn eigen waardes, hopelijk lukt dit. Lukt dit niet, dan zal ik u nog een appje sturen. Bedankt alvast!
Mvg, jaap
docent Dick
ExpertBeste Jaap,
Prima.
Groeten,
Dick
Jaap
GastBeste Dick,
Dit heb ik nu staan:
<span class=”TextRun SCXW178070871 BCX0″ lang=”NL-NL” xml:lang=”NL-NL” data-contrast=”none”><span class=”NormalTextRun SCXW178070871 BCX0″>In grafiek 2 is er een equivalentiepunt op een toegevoegde hoeveelheid zwavelzuur van 19,8 mL. </span></span><span class=”LineBreakBlob BlobObject DragDrop SCXW178070871 BCX0″><span class=”SCXW178070871 BCX0″> </span><br class=”SCXW178070871 BCX0″ /></span><span class=”TextRun SCXW178070871 BCX0″ lang=”NL-NL” xml:lang=”NL-NL” data-contrast=”none”><span class=”NormalTextRun SCXW178070871 BCX0″>De proef begon met 25 mL natronloog (0,4487 M), dit is: 25 * 0,4487 * 2 = 22,44 mmol OH</span></span><span class=”TextRun SCXW178070871 BCX0″ lang=”NL-NL” xml:lang=”NL-NL” data-contrast=”none”><span class=”NormalTextRun Superscript SCXW178070871 BCX0″ data-fontsize=”11″>-</span> </span><span class=”TextRun SCXW178070871 BCX0″ lang=”NL-NL” xml:lang=”NL-NL” data-contrast=”none”><span class=”NormalTextRun SCXW178070871 BCX0″>-</span><span class=”NormalTextRun SCXW178070871 BCX0″>ionen</span><span class=”NormalTextRun SCXW178070871 BCX0″>. </span><span class=”NormalTextRun SCXW178070871 BCX0″>Deze zijn allemaal op gereageerd bij een toevoeging van 19,8 mL zwavelzuur. Dus de molariteit van de onderzochte nat</span><span class=”NormalTextRun SCXW178070871 BCX0″>ronloog is </span><span class=”NormalTextRun SCXW178070871 BCX0″>22,44/19,8 = 1,13 Mol/L</span><span class=”NormalTextRun SCXW178070871 BCX0″>.</span></span><span class=”EOP SCXW178070871 BCX0″ data-ccp-props=”{"201341983":0,"335559739":160,"335559740":259}”> </span>
Klopt dit, het was even verwarrend dat het ging om natronloog waar zwavelzuur aan toegevoegd werd en niet andersom, daarom ben ik benieuwd of het wel klopt.
Mvg, Jaap
Jaap
GastPardon er is iets fout gegaan.
<span class=”LineBreakBlob BlobObject DragDrop SCXW178070871 BCX0″><span class=”SCXW178070871 BCX0″>Het equivalentiepunt is 19,8 mL
De proef begon met 25 mL natronloog van 0,4487 M, dit is: 25 * 0,4487 * 2 = 22,44 mmol OH–ionen. Deze zijn allemaal op gereageerd bij een toevoeging van 19,8 mL zwavelzuur. Dus de molariteit van de onderzochte natronloog is 22,44/19,8 = 1,13 Mol/L
</span></span>Klopt dit?
Mvg, Jaap
Jaap
GastHet lukt me niet om het anders te versturen, hopelijk kunt u het toch lezen.
docent Dick
ExpertBeste Jaap,
25,0 ml 0,4487 M natronloog bevat 25,0*0,4487 mmol OH– = 11,22 mmol OH–
Bij het eindpunt van de titratie heb je dus 11,22 mmol H3O+ toegevoegd.
11,22 mmol H3O+ komt overeen met 11,22/2 mmol H2SO4 = 5,61 mmol H2SO4 !!!
5,61 mmol H2SO4 in 19,8 mL
de molariteit van de zwavelzuur oplossing is dus: 5,61/19,8 = 0,283
Is deze uitleg voldoende duidelijk?
Groeten,
Dick
Jaap
GastBeste Dick,
Ik moet de molariteit van natronloog weten, niet die van zwavelzuur
Mvg,
Jaapdocent Dick
ExpertBeste Jaap,
Je schreef:
Het equivalentiepunt is 19,8 mL
De proef begon met 25 mL natronloog van 0,4487 M, dit is: 25 * 0,4487 * 2 = 22,44 mmol OH–ionen.Deze zijn allemaal op gereageerd bij een toevoeging van 19,8 mL zwavelzuur.
Nu is dus even spraakverwarring!
Je zegt dat je de molariteit van de natronloog moet berekenen.
Dat betekent dat je uitgegaan bent van 25,0 mL natronloog waaraan je 19,8 mL 0,4487 M zwavelzuur aan hebt toegevoegd?
In dat geval: 19,8 * 0,4487 * 2 mmol H3O+ = 17,77 mmol H3O+
Dan bevat 25,0 mL natronloog 17,77 mmol OH–.
Molariteit van de natronloog is 17,77/25,0 = 0,711
Laat mij even weten of ik het nu goed heb begrepen.
Groeten,
Dick
Jaap
GastBeste Dick,
Ik ben vergeten te vertellen dat het gaat om een oplossing van 25 mL natronloog met daarbij een bepaalde hoeveelheid gedestilleerd water, die onbekend is.
Mvg, Jaap
-
AuteurBerichten
Bekijk ook eens

Vraag
fasen van stoffen in een reactievergelijking

Leertip
10 tips om uitlegvideo’s effectief te gebruiken

Vraag
Zuren en basen

Vraag
azijnzuur en zuur-base

Vraag
Uitleg vraag 22 van scheikunde examen 2023 eerste tijdvak.

Vraag
Zuur-Base en redox

Vraag
Halfreacties

Vraag
Zuren en basen

Vraag
hydrofiel of hydrofoob?




