docent Dick
Aangemaakte reacties
-
AuteurBerichten
-
10 juni 2023 om 18:50 In reactie op: Aanwezige ionen bij reactie kalkwater en koolstofdioxide #157768
docent Dick
ExpertBeste Isabelle,
Je hebt een oplossing van kalkwater, dat bestaat uit Ca2+(aq), OH–(aq) en H2O.
[Ca2+(aq)] : [OH–(aq) = 1 : 2
Als je nu CO2 in het kalkwater leidt, ontstaat er H2CO3 (via H2O + CO2 –> H2CO3)
Er is in het begin een overmaat OH– aanwezig dus de H2CO3 staat 2 H+ af en wordt CO32-, waardoor er CaCO3 neerslaat.
Dit proces gaat door tot dat alle OH– heeft gereageerd. Alle calciumionen zijn nu neer geslagen als CaCO3 .
De geleidbaarheid is op het laagste punt.
Voeg je nu nog meer CO2 toe dan krijg je de volgende reactie:
H2O + CO2 —> H2CO3
CaCO3 (s) + H2CO3 —> Ca2+ + 2 HCO3–.
De geleidbaarheid neemt nu weer toe!
Heb ik een en ander zo duidelijk gemaakt voor je?
Zo niet, dan zie ik je vervolgvraag wel.
Groeten,
Dick
docent Dick
ExpertBeste Jaap,
Beide reacties zijn zuur-basereacties.
kalkwater is een oplossing van calciumhydroxide in water, dat geef je weer al Ca2+(aq) en OH–(aq), klopt!
In kalkwater is de molverhouding Ca2+(aq): OH–(aq) = 1:2
Als CO2 In water komt, ontstaat er H2CO3..
Als je kalkwater en CO2 laat reageren in de molverhouding 1: 1, Reageert 2 mol OH– met 1 mol H2CO3 en ontdstaat er 1 mol CaCO3.
.Als je kalkwater en CO2 laat reageren in de molverhouding 1:2. Reageert 2 mol OH– met 2 mol H2CO3 tot 2 mol HCO3–.
Ik leerde mijn leerlingen altijd eerst op te schijven welke deeltjes je bij elkaar voegt.
Kalkwater en CO2: Ca2+(aq), OH–(aq), H2O(l), CO2 (g).
En dan kijken wat er reageert (zie eerdere reactie van mij).
Even een ander voorbeeld:
Een suspensie van calciumcarbonaat in water reageert met CO2.
CaCO3(s) , H2O(l) , CO2(g)
H2O + CO2 —> H2CO3
CaCO3 (s) + H2CO3 —-> Ca2+ + 2 HCO3–
Is dit voldoende duidelijk?
Zo niet, dan zie je je vervolgvraag weer graag tegemoet.
Dic k
10 juni 2023 om 17:33 In reactie op: Aanwezige ionen bij reactie kalkwater en koolstofdioxide #157763docent Dick
ExpertBeste Isabelle,
Je redeneert in het begin grotendeels goed!
Als de geleiding minimaal is heb je de kleinste concentratie ionen.
Als kalkwater reageert met CO2 in de molverhouding 1:1 ontstaat er calciumcarbonaat dat neerslaat. De OH– -ionen hebben gereageerd met CO2 en de calcium zijn gebonden in carbonaat.
Eigenlijk heb je dan alleen de maken met het evenwicht CaCO3(s) <—> (evenwichtsteken) Ca2+(aq) + CO32-(aq)
Verder kom ik niet en ik ben er ook niet zeker van dat CaCO3 een neerslag geeft in dit geval en of het dan volledig neerslaat aangezien het maar matig oplosbaar is in water (staat in de binas). Kunnen jullie mij verder helpen?
In tabel 45 staat echt dat CaCO3 slecht oplosbaar is!
Let op als de verhouding tussen CO2 en kalkwater 2:1 is (overmaat CO2) dan ontstaat er een andere situatie
Het eerder gevormde neerslag gaat in oplossing!
CO2 + H2O –> H2CO3
CaCO3 (s) + H2CO3 —-> 2 HCO3– + Ca2+
Calciumwaterstofcarbonaat is wel goed oplosbaar in water!
Geeft dit antwoord je duidelijkheid?
Zo niet, stel dan gerust je vervolgvraag.
Dick
docent Dick
ExpertBeste Jaap,
De eerste reactievergelijking is bijna goed.
Kalkwater is matig oplosbaar. In de oplossing heb je: Ca2+(aq), OH–(aq) en Ca(OH)2 (s).
CO2 + H2O –> H2CO3
H2CO3 + 2 OH– —> 2 H2O + CO32-
Ca2+ + CO32- —> CaCO3(s)
———————————————-
CO2 + Ca2+ + 2 OH– —> CaCO3(s) + H2O
Bij overmaat CO2 (ondermaat kalkwater)
CO2 + H2O –> H2CO3
H2CO3 + OH– —> H2O + HCO3–
————————————————
CO2 + OH– –> HCO3–
Calciumwaterstofcarbonaat is in water oplosbaar
Dus houd je nu een oplossing van calciumwaterstofcarbonaat over: Ca2+(aq) + HCO3–(aq)
Groeten,
Dick
docent Dick
ExpertBeste A,
Hierbij een aanvulling op het antwoord van mijn collega,
De bouw van het molecuul speelt ook een belangrijke rol.
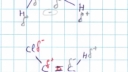
In de bijlage heb ik de structuurformules van cis 1,2-dichlooretheen en trans 1,2-dichlooretheen getekend.
Eerst de cis isomeer:
Chloor ie electronegatiever dan koolstof, dus de elektronen van de C-Cl bindingen liggen iets dichter bij het chlooratomen . Gevolg: Chlooratomen delta – en de koolstofatomen,delta +.
Koolstof is elektronegatiever dan waterstof, dus de elektronen van de C-H bindingen liggen iets dichterbij de koolstofatomen.
Gevolg: Waterstofatomen delta+ en koolstofatomen delta -.
De centra van + en – vallen niet samen. De cis isomeer heeft een dipool.
Dan de trans isomeer:
Chloor ie electronegatiever dan koolstof, dus de elektronen van de C-Cl bindingen liggen iets dichter bij het chlooratomen . Gevolg: Chlooratomen delta – en de koolstofatomen,delta +.
Koolstof is elektronegatiever dan waterstof, dus de elektronen van de C-H bindingen liggen iets dichterbij de koolstofatomen.
Gevolg: Waterstofatomen delta+ en koolstofatomen delta -.
De centra van + en – vallen nu samen! De trans isomeer heeft GEEN dipool.
Ik hoop dat deze aanvulling je verder helpt.
Heb je nog aanvullende vragen, dan vernemen we die graag.
Dick
Je ziet dat de + gel
Bijlagen:
21 mei 2023 om 12:22 In reactie op: zuur-base: deeltjes (in dit geval aminozuren) in basische en zure milieus #157213docent Dick
ExpertBeste Quincy,
In basisch milieu wil zeggen dat de pH van de oplossing >7 is.
De zuurgroep van alanine staat een H+ af
~COOH + OH– —> ~COO– + H2O
Is dit nu duidelijk?
Zo niet, stel gerust je vervolgvraag.
Dick
docent Dick
ExpertBeste Charlotte,
Bij Si, P, N of S kan het aantal omringende elektronen in sommige gevallen groter zijn (>8).
Zie uitleg in attachfile.
Verduidelijkt deze uitleg?
Groeten,
Dick
Bijlagen:
docent Dick
ExpertHoi Sven,
vraag 1.
PO43- reageert met water in een evenwicht tot HPO42- en OH–
In principe kan ook HPO4– met water een tweede evenwicht geven tot H2PO4– en OH–
Tot slot kan dit nog een keer met water onder vorming van H3PO4 en OH–
Het 2e en 3e evenwicht hebben een kleine en zeer kleine Kb.
Als we bijv. natriumfosfaat in water oplossen, dan wordt de pH van de oplossing bepaald door het eerste evenwicht.
Kijk maar in je BINAS tabel 49 naar de andere Kb‘s,
Omdat H3O+ een sterk zuur is krijg je met PO43- (een zwakke base) een aflopende reactie naar rechts tot H3PO4.
Vraag 2.
Een zuurbase reactie van een (zwak) zuur met een (zwakke) base verloopt als de Kz > Kb klopt.
Kz van H2C2O4 is > Kb van PO43- en
Kz van H2C2O4 is > Kb van HPO42- en
Kz van H2C2O4 is > Kb van van H2PO4–
Kz van HC2O4– is > Kb van PO43-
Kz van HC2O4– is > Kb van HPO42-
3 H2C2O4 + PO43- –> 3 HC2O4– + H3PO4
2 HC2O4– + PO43- –>2 C2O42- + H2PO4
———————————————————–
3 H2C2O4 + 2 PO43- —> HC2O4– + H3PO4 + H2PO4–
Bij jou uitleg heb je even niet in de gaten dat de Kz van HC2O4– > Kb van HPO42-
Verder klopt deze vergelijking niet: H2C2O4 + PO43- <–> 3 HC2O4– + H2PO4–.
dit moet zijn: 2 H2C2O4 + PO43- <–> 2 HC2O4– + H2PO4–.
Helpt dit je verder?
Groeten,
Dick
docent Dick
ExpertBeste Sam,
Je vroeg je af wat je bij opgave 2 en 3 fout hebt gedaan.
Ik heb in de bijlage de sommen uitgewerkt.
Helpt dat om je te laten zien hoe je dit aanpakt?
Tot slot vraag je: – Hoe bereken je een dissociatiegraad met inhoud reactievat, mol van verschillende stoffen, Kc en temperatuur.
Die vraag moet je voor mij verduidelijken voor een goed antwoord..
Ik schat in dat je in zo’n geval ook met een BOE -tabel kan werken.
Bijlagen:
docent Dick
ExpertBeste Sam,
ik heb je eerste vraag, het antwoord Van Kees en je tweede vraag gelezen.
Het eerste wat mij opvalt is dat bij de eerste vraag geen volume is gegeven.
Dat heb je echt nodig om de concentratie te berekenen.
Daarnaast is het handig te werken met een tabel, zie bijlage.
Bij de tweede opgave geldt hetzelfde.
Ten aanzien van de partiele druk:
Als je een mengsel van gassen hebt, is de totale druk in het systeem gelijk aan de som van de partiele drukken.
pH2 + pI2+pHI= totale druk
De ‘partiële druk’ verwijst naar de druk die elk gas in een gasmengsel uitoefent op zijn omgeving, zoals een erlenmeyer, de zuurstoffles van een duiker of de grens van de atmosfeer. Je kunt de druk van elk gas in een mengsel afzonderlijk berekenen als je weet hoeveel van dat gas aanwezig is, welk volume het in beslag neemt, en wat de temperatuur is. Vervolgens kun je deze gedeeltelijke druk bij elkaar optellen voor de totale druk van het gasmengsel, of je berekent eerst de totale druk, om vervolgens de partiële druk van elk gas te bepalen.
Voor Kp zie ook de bijlage,
Als bovenstaande niet voldoende is, reageer dan opnieuw en stuur je berekeningen mee, dan kunnen wij kijken waar eventueel je fout of kennisdip zit.
Succes.
Dick
Bijlagen:
docent Dick
ExpertBeste Tim,
Als een batterij stroom levert, moet de stroomkring altijd gesloten zijn.
Je hebt een reactie bij de positieve pool en een reactie bij de negatieve pool.
Tussen de polen stromen de elektronen (via de draad of ander contact) van de – pool naar de + pool.
In de batterij verzorgen ionen het ladingstransport.
Dit ladingtransport kan worden verzorgd door een elektrolyt.
Wanneer de ruimtes tussen de + pool en de – pool gescheiden zijn door een membraan dan vindt het ladingstransport plaats doordat positieve of negatieve ionen zich door het membraan van de ene ruimte naar de andere ruimte verplaatsen om het ontstane ladingsverschil in die ruimten op te heffen.
Heb ik je vraag hiermee beantwoord?
Als je nog een vervolgvraag hebt, dan zien we die graag tegemoet.
Dick
docent Dick
ExpertHoi Tom,
IJzer(II)nitraat lost op in water.
Je hebt dan Fe3+(aq) en NO3–(aq)
Fe3+(aq) is een zwak zuur!
Voor Fe3+(aq) schrijven we dan Fe(H2O)63+!
Fe(H2O)63+ is een zwak zuur, je kunt dus de evenwichtsvergelijking opschrijven waarbij Fe(H2O)63+ 1 H+ afstaat.
Je weet hoeveel gram ijzer(III)nitraat nonahydraat is opgelost. Ik neem aan in 1 liter? ( In je vraag staat namelijk het volume niet gegeven) dus kun je de beginconcentratie Fe(H2O)63+ berekenen.
De pH is gegeven dus je [H3o+] uitrekenen.
Alles invullen in de evenwichtsvoorwaarde en nu kun je de Kz berekenen.
Helpt dit je voldoende op weg?
Zo niet, dan zien we je vervolgvraag graag tegemoet.
Dick
docent Dick
ExpertBeste Sam,
In principe is zowel jouw antwoord als het gegeven antwoord goed.
In jouw lesmethode is je aangeleerd, dat als je een oplossing van zuur hebt, bijv. zoutzuur, je de volgende reactievergelijking opschrijft: HCl + H2O –> H3O+ + Cl–.
Met andere woorden een zure oplossing bevat H3O+-ionen,
In de vraag zal waarschijnlijk staan H2S reageert met een oplossing van cadmiumnitraat.
Je hebt dus: Cd2+(aq) en NO3–(aq) en H2S(g)
Omdat er een neerslag van cadmiumsulfide ontstaat en er twee H+-ionen vrijkomen, moet je voor de pijl 2 H2O moleculen schrijven omdat er 2 H3O+ ontstaat.
Je weet dat we bij halfvergelijkingen in BINAS tabel 48 H+ schrijven i.p.v. H3O+ .
Helpt deze toelichting je verder?
Groeten,
Dick
docent Dick
ExpertBeste Matte,
Jouw gegeven formule omgewerkt:
kpv= n * A * molkpv /P*MM
K is volgens mijn gegevens 0,512 kg.oC/mol of 0,512 kg. K(elvin)/mol
Of je in de formule een C of K gebruikt voor de molaire kookpuntsverhoging maakt volgens mij niet uit.
Volgens mij is kpv: 0,27 oC of 0,27 K.
Heb ik je zo voldoende op weg geholpen?
docent Dick
ExpertBeste Leanne,
Een additiereactie is een chemische reactie waarbij uit twee moleculen 1 nieuw molecuul wordt gevormd.
bijv. etheen + broom –> 1,2-dibroomethaan
Een substitutiereactie is een chemische reactie waarbij een atoom of een atoomgroep wordt vervangen door een ander atoom of atoomgroep..
bijv. chloor + methaan —> chloormethaan en HCl
ethanol + HCl –> chloorethaan en water
Groeten,
Dick
-
AuteurBerichten