Siebe Lekanne Deprez
Aangemaakte reacties
-
AuteurBerichten
-
Siebe Lekanne Deprez
ExpertHoi Melissa,
Het is een erg interessante vraag over NaCl en hoe je daarmee glas kan maken. Hoe zou je deze vraag aanpakken? Ik ga niet het antwoord vorozeggen en waarschijnlijk heb je al door dat je moet (mol)rekenen uitgaande van de titel.
Groetjes,
Siebe Lekanne Deprez
Siebe Lekanne Deprez
ExpertHoi Sander,
Wat een leuke vraag! Dit soort vragen zijn altijd belangrijk om te weten waar je eigenlijk mee bezig bent als je het over scheikunde hebt. Je kan deze vraag op meerdere niveaus behandelen (steeds dieper gaan) en geef vooral aan of het antwoord hieronder je vraag beantwoord op jouw niveau.
Waarom gebeuren reacties?
Bijna alle processen die we meemaken in ons dagelijkse leven hebben een neiging om lager in energie te komen, oftewel op zoek te gaan naar een “stabielere toestand”. Denk hierbij aan afkoelende thee die energie overdraagt aan de omgeving, licht dat wordt uitgestraald door de zon, een verbrandingsreactie waarbij de producten stabieler zijn dan de reactanten, en meer. Misschien heb je het al langs zien komen in je scheikundelessen, maar je kan dit soort processen in een energiediagram weergeven (zie hieronder). Hoe lager in het diagram, hoe stabieler de stof of toestand van een stof is.
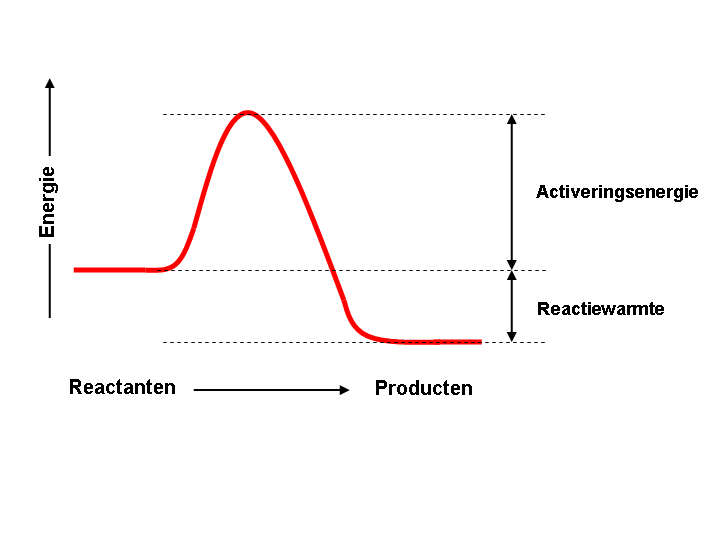
De reden waarom er reacties gebeuren, is daarom dat er een drijvende kracht is om zo laag mogelijk is energie te komen.
Hoe komt er energie vrij bij reacties, of hoe kosten reacties juist energie?
De kern hierbij is, is dat er allemaal interacties plaatsvinden tussen atomen zoals van der Waals interacties tussen grote moleculen die daardoor elkaar aantrekken,maar ook op een kleine schaal wat wij een “chemische binding” noemen. Zo zijn driedubbele bindingen sterker dan enkelvoudige bindingen. Dus kost het ook meer energie om die binding te breken.
Een reactie kost energie wanneer de bindingen van de beginstoffen / reactanten allemaal sterker zijn dan bij het product. Andersom heb je dat er energie vrijkomt wanneer je producten sterkere bindingen heeft dan de reactanten. Je kan dit bijvoorbeeld zelf uitrekenen door een verbrandingsreactie te nemen (bijvoorbeeld CH4 + 2 O2 -> 2 H2O + CO2) en hiervan de bindingssterktes op te zoeken (Binas tabel 58, of internet). Je zult zien dat hier een negatief getal uitkomt voor de hoeveelheid energie. Dat betekent dat er energie vrijkomt. Probeer maar!
Waarom komt er energie vrij bij redoxreacties in batterijen?
Bij een redoxreactie verliest een atoom een elektron (reductor), en een ander molecuul/atoom neemt de elektron op (oxidator). De reden dat er energie vrijkomt bij redoxreacties in batterijen heeft te maken met de verschil in de neiging van stoffen om elektronen af te staan (oxidatie) of elektronen op te nemen (reductie). Dit verschil in elektronenaffiniteit zorgt ervoor dat een redoxreactie kan plaatsvinden.
Beantwoordt deze uitleg jouw vraag?
Groetjes,
Siebe
Siebe Lekanne Deprez
ExpertHoi Fatima,
Je lijkt al goed op weg te zijn. Voor spectrofotometrie wordt ppm (parts per million, dus één deeltje op één miljoen andere deeltjes) gebruikt vanwege de lage concentraties. Dit is dus een uitdrukking voor een verhouding.
In jouw geval is de eenheid “mg/L” hetzelfde als ppm.
Waarom? Als je water als oplosmiddel hebt met een dichtheid van 1 g/L, dan stelt de eenheid “mg/L” voor alsof je 1 mg / 1.000.000 mg hebt. Dit is een massaverhouding van 1 op een miljoen, wat gelijk is aan ppm. De eenheden mogen alleen gelijk aan elkaar gesteld worden wanneer het verschil in dichtheid en volume bij verschillende concentraties verwaarloosbaar is. Als je het zeker wilt weten, kan je misschien je practicumbegeleider vragen of de practicumhandleiding goed doorlezen.
Kortom, je doet het goed door 20,05 mg/L te zien als 20.05 ppm. Let op dat de significantie klopt (drie significante eenheden in “0.0577 g KMnO4”).
Wat ik overigens niet helemaal kan volgen, is hoe je op de 20.05 mg/L bent gekomen. Aangezien concentratie massa/volume is, zou ik denken dat je 0.0577 g / 1 L = 0.0577 g/L => 57.7 mg/L hebt.
Groetjes,
Siebe Lekanne Deprez
Siebe Lekanne Deprez
ExpertHoi Tijn,
Bedankt voor je vraag! In principe reageren een reductor en oxidator met elkaar bij een redoxreactie. Het kan alleen zo zijn dat de gevormde producten verder reageren in andere redoxreacties.
Een mooi voorbeeld is hoe menselijke cellen energie halen uit voedsel, namelijk door een reeks redoxreacties waar stukje bij beetje energie wordt overgedragen naar andere moleculen. De reeks bestaat uit vier redoxreacties met enzymen en het heet de “elektronentransportketen” (als je geïnteresseerd erin bent: https://studyboard.be/Cursussen/biologie/Lessen/3-stofwisseling-en-energie/Topics/3-4-4-aerobe-celademhaling-4/. De stof kan wel vrij ingewikkeld overkomen dus schrik er niet van)
Hopelijk heb ik hiermee je vraag beantwoord!
Groetjes,
Siebe
Siebe Lekanne Deprez
ExpertHoi Sven,
Jouw vraag heeft bij ons in de redactie geleid tot een gesprek waar we verschillende aspecten met elkaar deelden. We hebben de antwoorden bij elkaar genomen en het voor jou inzichtelijk gemaakt. Hopelijk helpt dit!
1. Een batterij heeft een lagere capiciteit bij lagere temperaturen omdat het potentiaalverschil kleiner wordt. Met formules kan je dit aan de hand van de Wet van Nernst beredeneren (tabel 37D in je BiNaS) doordat temperatuur (T) in de teller staat. De Wet van Nernst geeft de relatie tussen verschillende variabelen (waaronder concentratie en temperatuur) en het potentiaalverschil Een kleinere T zorgt een voor een kleiner getal en dus een kleiner potentiaal verschil.
Extra: conceptueel kan je denken dat in de cel het moeilijker is om ionen los te maken bij een lagere temperatuur. Sneller leeggaan lijkt mij het gevolg van een lagere capiciteit (minder energie beschikbaar om over te dragen)
2. Zelfontlading zijn ongewenste nevenreacties die optreden in een cel. Een voorbeeld is ionen die ongewenst loskomen en migreren naar de andere kant van de cel en daar “aankoeken”. Het aankoeken zorgt ervoor dat de capaciteit minder wordt.
Groetjes,
Siebe
Siebe Lekanne Deprez
ExpertHoi Sarah,
De reactiesnelheid hoeft niet gelijk aan 0 te zijn als er een evenwicht is. Een evenwicht betekent dat de concentraties van de stoffen aan beide kanten van de reactiepijl niet meer veranderen door de tijd heen. Dus de concentraties blijven gelijk, maar dat hoeft niet te betekenen dat de concentratie van bijvoorbeeld stof A gelijk is aan die van stof B voor de reactie A <-> B.
Zo kan er bijvoorbeeld meer A dan B aanwezig zijn, maar als de reactie van A naar B langzamer is dan van B naar A zal beide concentraties gelijk blijven. Hier spreken we van een evenwicht.
Helpt dit je verder op weg?
Siebe
Siebe Lekanne Deprez
ExpertHoi Sam,
Je mag ervan uitgaan dat de verdunde oplossing bijna dezelfde dichtheid heeft als water.
Van het gesprek met Jan Wim Peters zie ik dat je op zoek bent naar een manier om de massa van sinaasappelsap te bepalen. Dit wil je vervolgens gebruiken om het massapercentage citrzoenzuur in het sap te berekenen.
Eerst wil ik nog kort terugkomen op de verdunning: 50 mL verdund betekent inderdaad dat je met 500 mL moet rekenen.
Wanneer je tijdens je toets de massa van het verdunde sap moet bepalen (zonder dat je mag meten), kan je dat doen door inderdaad aan te nemen dat de dichtheid dicht bij die van water ligt. De redenen voor de aanname is dat je het sap 10x hebt verdund met water en dat sinaasappelsap zelf al veel water bevat. Dus, dan heb het volume (in mL) en de dichtheid (g/mL) en kan je de massa bepalen.
Kan je zo verder?
Groetjes,
Siebe
Siebe Lekanne Deprez
ExpertHoi Joost,
Binnen het team werd ik terecht gewezen op het feit dat je een andere BINAS gebruikt dan die ik in gedachte had. Sorry hiervoor. Ik heb te horen gekregen dat je de eerste paar koolwaterstoffen uit je hoofd moet leren waarvoor je een handige richtlijn kan gebruiken (#C duidt hoeveel koolstofatomen in het molecuul zitten):
1C = meth(aan)
2C = etha(an)
3C = propa(an)
4C = but(aan)
5C = pent(aan)
6C = hex(aan)
Let vooral op de dikgedrukte aanduidingen omdat die de hoeveelheid aangeven. Deze naamgeving komt altijd terug in het benoemen van koolwaterstoffen. Kom je er zo uit samen met de formule die ik eerder heb gegeven?
Groetjes, Siebe
Siebe Lekanne Deprez
ExpertHoi Joost,
Altijd als je iets van elementen wilt weten, of dat de naam is, molecuulmassa, of lading, dan is het periodiek systeem dé figuur om op te zoeken. In dat systeem staan namelijk alle elementen die ontdekt zijn en ik denk dat Sr er vast ook bij zal staan. Het periodiek systeem staat in je BINAS of je kan gebruik maken van onder andere deze link:
https://ptable.com/#Properties
Laat maar weten als je het hebt kunnen vinden!
Groetjes, Siebe
Siebe Lekanne Deprez
ExpertHoi Joost,
Methaan is deel van de klasse “koolwaterstoffen” waarvan je denk ik wel hebt gehoord. Denk bijvoorbeeld aan benzine voor auto’s, aardgas voor fornuizen en nog meer. Voor deze klasse is er een algemene formule: C_(n)H_(2+2n) waar n bepaalt hoeveel koolstofatomen aanwezig zijn in het molecuul. Probeer eens te achterhalen hoeveel koolstofatomen (of atoom) er in methaan zit.
Mocht je er niet uitkomen, dan kan je je BINAS gebruiken waar de molecuulformule in tabel 66B staat. Anders zou je ook nog methaan kunnen Googelen, maar dat kan denk ik niet tijdens een toets
Groetjes, Siebe
Siebe Lekanne Deprez
ExpertHoi Steijn,
Bedankt voor je vraag en de crux zit hem in het feit dat er water in combinatie met ionen aanwezig zijn. Als we naar de reactievergelijking kijken dan zien we dat er water aanwezig is in combinatie met F- en OH- ionen. Water kan fantastisch ladingen stabiliseren en dus zullen de watermoleculen rond de ionen gaan zitten. Met andere woorden, de moleculen (F- , HF, OH-) worden opgelost.
Dit geven we aan met “aq” , wat wil zeggen dat elk molecuul (F- , HF, OH-) omringd is door een veelvoud aan watermoleculen, en zoals de reactievergelijking laat zien, een deel van deze watermoleculen reageert met fluoride F-.
De moleculen (F- , HF, OH-) worden niet gasvormig omdat ze daarvoor te graag te graag omring willen zijn door water (ladingen stabiliseren), en ook niet vloeibaar omdat er heeeeeel veel watermoleculen zijn voor ieder F- , HF of OH- atoom. Daarom zie je bij H2O wel (l) staan, omdat dat veel meer aanwezig is dan de andere moleculen. Tot slot is er geen vaste toestand (s) omdat dit zou betekenen dat bijvoorbeeld alle F- moleculen een rooster zouden vormen, wat heel instabiel zou zijn met alle negatieve ladingen zo dicht bij elkaar. Het resultaat is dat de moleculen opgelost zijn in water, wat we met (aq) aanduiden.
Beantwoordt dit je vraag?
Groetjes,
Siebe
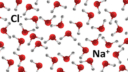
PS: in de bijlage kan je een weergave zien van wat het betekent voor een ion/molecuul om opgelost te zijn in water. Dit is echter wel voor NaCl (keukenzout) gedaan, maar het principe is hetzelfde; er zijn veel meer watermoleculen dan ionen.
Siebe Lekanne Deprez
ExpertHoi Zeger,
Heel goed opgemerkt! Deze reactievergelijking is inderdaad niet kloppend en mijn vermoeden is dat het een fout in het boek is. Je kan komende week naar je docent toegaan en diegene op deze niet-kloppende reactie wijzen. Wellicht zal de docent erg blij zijn dat je het aanstipt 🙂
Overigens, zou je een idee hebben hoe je deze reactie wel kloppend kan maken? Hoe zal de reactievergelijking er dan uitzien?
Groetjes,
Siebe Lekanne Deprez
Siebe Lekanne Deprez
ExpertHoi Ed,
De redenering klopt inderdaad dat je zou verwachten dat er geen dipoolmoment is vanwege de symmetrie. Je kunt namelijk malonic acid 180 graden draaien en je krijgt hetzelfde resultaat.
Ook heb je goed door dat een stof pas in water oplost als er gunstige waterstofbruggen gevormd kunnen worden tussen malonic acid en water, maar voor waterstofbruggen heb je ladingsscheiding/dipolen nodig zoals je terecht noemt.
Dit levert een tegenstelling op en om het op te lossen, kun je kijken of de symmetrie gebroken wordt. Zou malonic acid omgeven door water een andere (of geen) symmetrie vertonen? In dat geval zullen er namelijk wel H-bruggen gevormd worden aangezien de partiële ladingen elkaar niet meer opheffen.
Als je denkt dat je een antwoord hebt, dan kan je kijken in de bijlage waar ik malonic acid heb weergegeven met wel/geen dipoolmoment in groen. Kun je aan de hand van structuur redeneren waarom het nu wel/geen dipoolmoment heeft?
Siebe Lekanne Deprez
ExpertHoi Jiske,
Laten we even teruggaan naar het begin om te weten wat we willen weten en hoe we dat moeten aanpakken.
De vraag is een typische verhouding vraag waar je kijkt naar hoe vaak een deel (25 mg Fe in het tablet) in het totaal past (het ijzer wat je nodig hebt voor 0.35 g Fe2CO3). Het is net zoiets als de vraag: hoeveel briefjes van 5 euro heb je nodig om 100 euro te krijgen?
Hetgeen wat dit soort vragen binnen scheikunde ingewikkelder maakt, is dat we niet simpelweg de hoeveelheid gram of liter door elkaar kunnen delen (zoals 0.35 g Fe2CO3 nodig / 0.0025 g Fe per tablet) want je hebt te maken met verschillende stoffen die een andere massa en verhouding hebben. De stap die je dus altijd zal moeten maken, is naar hoeveelheid mol gaan want die kan je wel vergelijken!
Hierboven heb ik gezien dat het lukt om 0.25 mg Fe in hoeveelheid mol uit te drukken. De volgende stap is te berekenen hoeveel mol ijzer in 0.35 g Fe2CO3 zit.
Wat je dan hebt berekend, is de hoeveelheid mol Fe2CO3, maar als je goed kijkt, dan zie je Fe2 erin staan terwijl de tabletten Fe bevat. Je moet dus corrigeren dat Fe2CO3 een dubbele hoeveelheid ijzer heeft ten opzichte van het zuivere ijzer Fe in de tabletten. Dit wordt ook wel een ‘molverhouding’ genoemd.
Lukt het nu om de vraag verder te beantwoorden?
Laat het maar weten!
Groetjes,
Siebe
-
Deze reactie is gewijzigd 2 jaren, 6 maanden geleden door
Siebe Lekanne Deprez.
Siebe Lekanne Deprez
ExpertHoi Ninthe,
Het heeft te maken met de informatie van in de vraag en hoe je de aminozuren in groepen van drie verdeeld.
Er wordt in de vraag aangegeven dat de aminozuur op positie 1 ook de eerste aminozuur van codon 1 is.
Als je deze gedachtegang doortrekt, dan zal aminozuren 1,2,3 coderen voor het eerste codon. Aminozuren op positie 4,5,6 voor het tweede codon en ga zo maar door. Je zie dat codons steeds in groepjes van drie opgebouwd zijn.Als je dit helemaal zou uitschrijven en uitwerken, dan kom je erachter dat aminozuren 1213,1214 en 1215 coderen voor codon 405. Om dit op een andere manier te bekijken, kan je bedenken dat 1215 perfect deelbaar door drie is (er blijft geen rest over) dus het aminozuur op positie 1215 moet het laatste codon zijn, anders zou je een rest overhouden zoals je krijgt als je positie 1216 of 1214 neemt.
Ik hoop dat het nu wat duidelijker is.
Groetjes,
Siebe
-
Deze reactie is gewijzigd 2 jaren, 6 maanden geleden door
-
AuteurBerichten