Waterstof is het lichtste en verreweg meest voorkomende element in het heelal. Zo’n vier vijfde van alle materie is waterstof. Het is de brandstof voor kernfusie in onze zon en sterren, en wellicht ooit op aarde. Waterstof komt in de atmosfeer voor als het twee-atomige molecuul diwaterstof (waterstofgas). Het gooit hoge ogen als toekomstige energiedrager en transportbrandstof, al is de opslag nog lastig. Het is zeer schoon te verbranden. Waterstof dankt zijn naam aan het verbrandingsproduct: stof die water voortbrengt.
Symbool
H
Protonen/elektronen
Groep
Isotopen
1H, 2H, 3H
Periode
1
Elektronenconfiguratie
1s1
Blok
s
Elektronencofiguratie Bohr
1
Bij kamertemperatuur
gas
Elektronegativiteit
2,1 (Pauling)
Dichtheid
0.084 kg m-3 (H2)
Atoomstraal
30 . 10-12m
Smeltpunt
-259 oC (14 K)
Relatieve atoommassa
1.00797
Kookpunt
-252.7 oC (20.3 K)
Soortelijke warmte
14300 J kg-1K-1
Warmtegeleidingscoëfficiënt
0.174 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Brandstof
Vloeibare waterstof dient als brandstof voor raketmotoren, onder andere voor de Spaceshuttle en de Ariane 5. Voor de lancering van de laatste twee is respectievelijk 10 ton en 120 ton vloeibare waterstof en zuurstof nodig. Raketmotoren zijn ook aan te drijven met reactieve waterstofverbindingen zoals hydrazine (N2H2, zie ook bij stikstof) en boorhydride (BH3).
Het gebruik van waterstof als brandstof voor auto’s is volop in onderzoek. Daarbij gaat het zowel om directe verbranding als om opwekking van elektrische energie. In beide gevallen is water is het schone reactieproduct.

Voor auto’s is de opslag van waterstof nog lastig. Het kan onder druk in tanks, net zoals bij LPG (propaan en butaan). Maar om een acceptabele actieradius te bereiken zijn relatief grote tanks of zeer hoge drukken nodig. Een geschikt alternatief lijkt de opslag in metaalhydriden.
Er zijn al wel onderzeeërs aangedreven door waterstof. Deze beschikken over brandstofcellen die het gas benutten voor de productie van elektriciteit. De elektromotoren zijn zeer stil en produceren nauwelijks warmte, hierdoor zijn deze onderzeeboten nauwelijks op te sporen.

Kernfusie
De brandstof bij kernfusie zijn natuurlijk voorkomende, stabiele isotopen van waterstof: deuterium 2H en tritium 3H. Als de kernen van deze atomen samensmelten tot helium komt erg veel energie vrij:
Kernfusie, de energiebron van onze zon en andere sterren, kan alleen plaatsvinden bij zeer hoge temperaturen van 100 tot 150 miljoen graden Celsius. Atoomkernen en elektronen zijn dan niet meer aan elkaar gebonden.

Kernfusie is veiliger dan kernsplijting: er is geen kettingreactie en er is minder radioactief afval. Bovendien is waterstof haast onbeperkt beschikbaar als grondstof. Kernfusie houdt dan ook de belofte in van een schone, veilige en langdurig bruikbare energiebron. Onderzoekers hopen met de internationale fusiereactor ITER (International Tokamak Experimental Reactor) de haalbaarheid van kernfusie definitief aan te kunnen tonen.
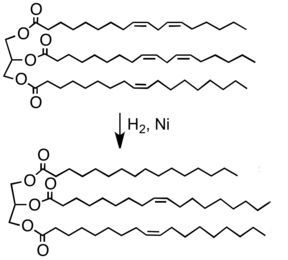
Vetharding
Bij de harding van vetten worden onverzadigde oliën en vetten omgezet in verzadigde oliën en vetten. Dit vindt plaats door additie van waterstof aan de dubbele bindingen (met bijvoorbeeld nikkel als katalysator):
Ammoniak
Ammoniak (NH3) vormt de basis van moderne stikstofmeststoffen. In 1913 vond bij BASF in Ludwigshafen de eerste industriële ammoniakproductie plaats volgens het Haber-Bosch proces. Dit is sindsdien eigenlijk nauwelijks gewijzigd.
De wereldproductie van ammoniak bedraagt nu ongeveer tweehonderd miljoen ton per jaar. Volgens schattingen is ongeveer een derde van de wereldbevolking afhankelijk van landbouwproducten geteeld met kunstmest op basis van Haber-Bosch ammoniak. De helft van de eiwitten in het menselijk lichaam zou stikstof bevatten die via industrieel geproduceerd ammoniak in de voedingsketen terecht is gekomen. Overigens heeft ammoniak ook minder positieve toepassingen: het vormt de basis voor de vervaardiging van explosieven.
De Duitse chemicus Fritz Haber (1868-1934) kreeg in 1918 de Nobelprijs Chemie voor de ontdekking van de syntheseroute naar ammoniak. Landgenoot Carl Bosch (1874-1940), chemisch technoloog, ontwikkelde er een industrieel proces voor. Hij kreeg de Nobelprijs in 1931.

Eén van de cruciale aspecten van het Haber-Bosch proces is de productie van moleculair waterstof. Dit gebeurt via de reactie van aardgas (of andere koolwaterstoffen) met stoom. Deze uitgangsstoffen worden samen met lucht (dat 78% stikstof bevat) over een nikkel katalysator geleid. Bij hoge temperatuur en druk treden dan de volgende reacties op:
.
.
Met het gevormde koolstofmonoxide is nog meer waterstof te maken door het gasmengsel over een andere katalysator (FeO/Cu) te leiden:
Het koolstofdioxide wordt verwijderd door het gasmengsel door een kaliumcarbonaat-oplossing te leiden:
en het overgebleven koolstofmonoxide verdwijnt door de reactie met waterstof:
Door de juiste hoeveelheden uitgangsstoffen te nemen heeft het overgebleven gasmengsel precies de juiste stikstof/waterstof verhouding voor de reactie tot ammoniak. Het bevat behalve waterstof (74,3%) en stikstof (24,7%) ook methaan (0,7%) en argon (0,3%). De omzetting tot ammoniak gebeurt bij een druk van 200.105 Pa en een temperatuur van 425 °C met behulp van een katalysator van zeer fijn verdeeld ijzer.
Deze reactie is een evenwichtsreactie. Bij de gegeven omstandigheden bevat het gasmengsel ongeveer 15 % ammoniak. Het wordt afgescheiden via condensatie, waarna het overblijvende gas opnieuw naar de reactor gaat.

Koelmiddel bij cryogene experimenten
Diwaterstof wordt gebruikt bij cryogene experimenten, die bij een temperatuur van ongeveer 20K uitgevoerd moeten worden.
Meer toepassingen
- Autogeen lassen
- Bellenvaten bij bestudering kernreacties (vloeibaar waterstof)
- Bereiding metalen
- Drinkwaterbereiding in de ruimtevaart
- Gasontladingslamp
- Methanolbereiding
- Ontzwavelen van aardolie
- Standaard waterstofelektrode
Naam & ontdekking
Naam
De Latijnse naam hydrogenium (vandaar het symbool H) is afgeleid van het Griekse hudor gennan. Dat betekent dan wel water en voortbrengen – waterstof is te bereiden uit water en vormt bij verbranding weer water. De Nederlandse benaming waterstof heeft ook die oorsprong: de stof waaruit water gevormd wordt.
Ontdekking
De Britse natuurkundige en chemicus Henry Cavendish ontdekte waterstof in 1766 bij zijn onderzoek naar de eigenschappen van zuren. Vrijwel alle zuren bleken met ijzer of zink te reageren, onder de vorming van steeds hetzelfde gas, dat veel lichter was dan lucht.

In 1781 stelde Cavendish vast dat het gas bij verbranding water vormde. Hij publiceerde zijn bevindingen in 1774, maar kon deze nog niet los zien van de heersende flogiston-theorie (een kleine eeuw eerder door de Duitse arts Georg Ernst Stahl geformuleerd). In deze theorie bevat iedere stof het zogenaamde flogiston, een een substantie zonder kleur, geur, smaak of gewicht, die de eigenschap van hitte in zich draagt. Flogiston zou uit het materiaal vrijgemaakt worden door verbranding.
De Britse scheikundige Humphrey Davy herkende het waterstof gas als een element. In 1789 slaagde de Nederlander Adriaan Paets van Troostwijck er in waterstof te bereiden door elektrolyse van verdunde zuren. Vervolgens kon hij het waterstofgas, met het tevens gevormde zuurstof, weer tot water synthetiseren.
Voorkomen
Voorkomen
Waterstof staat op plaats tien in de lijst van meest voorkomende elementen in de aardkorst. Het is goed voor zo’n 0,15 % van het totale gewicht. Gerekend naar aantallen atomen kun je zeggen dat van elke duizend er één waterstofatoom is.
In de oceanen zijn vanzelfsprekend veel waterstofatomen te vinden. De overbekende formule van water is immers H2O. Ongeveer 11% van zeewater is waterstof (op basis van gewicht).

Voor het menselijk lichaam geldt dat ongeveer 10% van het gewicht door waterstof wordt bepaald. Het element neemt daarbij de derde plaats in, na zuurstof en koolstof. In aantallen atomen staat waterstof bovenaan met een verbazingwekkende 62%.
De waterstofconcentratie in de atmosfeer is vrij constant (10-5 %), maar neemt aanzienlijk toe in de exosfeer, de buitenste laag van de atmosfeer (van ca. 600 tot 2000 km).

In het heelal is waterstof is het meest voorkomende element. De zon bestaat voor 84% uit waterstof, dat daar als energiebron dient voor de fusiereactie. Op Jupiter komt waterstof in vaste toestand voor omdat het er extreem koud is (de temperatuur ligt onder 20K).
Winning
Waterstof wordt verkregen door elektrolyse van water, en als bijproduct bij chemische processen. De EU heeft met de Critical Raw Materials Act in 2022 waterstof op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
Vroeger maakte men waterstof vooral via een reactie tussen zink en (zout)zuur. Deze reactie wordt op laboratoriumschaal nog wel toegepast:
Tegenwoordig
Nu past men ook elektrolyse toe van een natriumchloride-oplossing, van natronloog of van een zwavelzuuroplossing. Dit is economisch pas interessant als elektrische energie goedkoop is – denk bijvoorbeeld aan waterkrachtcentrales. Het levert wel zeer zuivere waterstof en wordt om die reden ook wel op kleine schaal toegepast met dure stroom.
Op industriële schaal ontstaat waterstof vaak door de reactie van koolstofhoudende verbindingen zoals cokes, aardgas of andere koolwaterstoffen met stoom, bij hoge temperatuur:
of
Met het gevormde koolstofmonoxide is verder uit stoom (en ijzer- of kobaltoxide als katalysator) nog meer waterstof te maken via de reactie:
(zie ook bij ammoniak, onder het tabblad Toepassingen).
Waterstof is ook een nevenproduct bij petrochemische processen.