Lithium is één van de drie elementen die tijdens de big bang werden gevormd, weliswaar in veel kleinere hoeveelheden dan waterstof en helium. Het is het lichtste van de alkalimetalen, in vaste vorm heeft het ruwweg de helft van de dichtheid van water. Lithium heeft een zilverachtig voorkomen dat snel dof wordt vanwege de reactie met lucht. Omdat het zeer reactief is komt het in de natuur niet in metallische vorm voor. Lithium wordt toegepast in lichtgewicht legeringen met aluminium en magnesium. Het is ook bekend van de toepassing in batterijen en als medicijn bij depressies.
Symbool
Li
Protonen/elektronen
Groep
Isotopen
6Li, 7Li
Periode
2
Elektronenconfiguratie
[He] 2s1
Blok
s
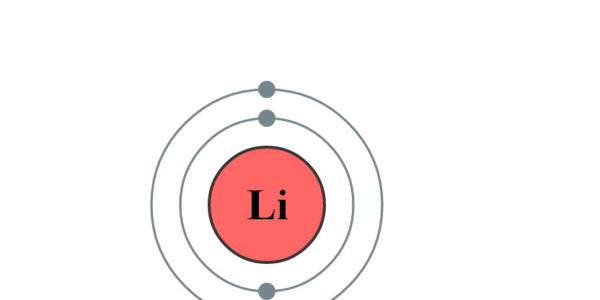
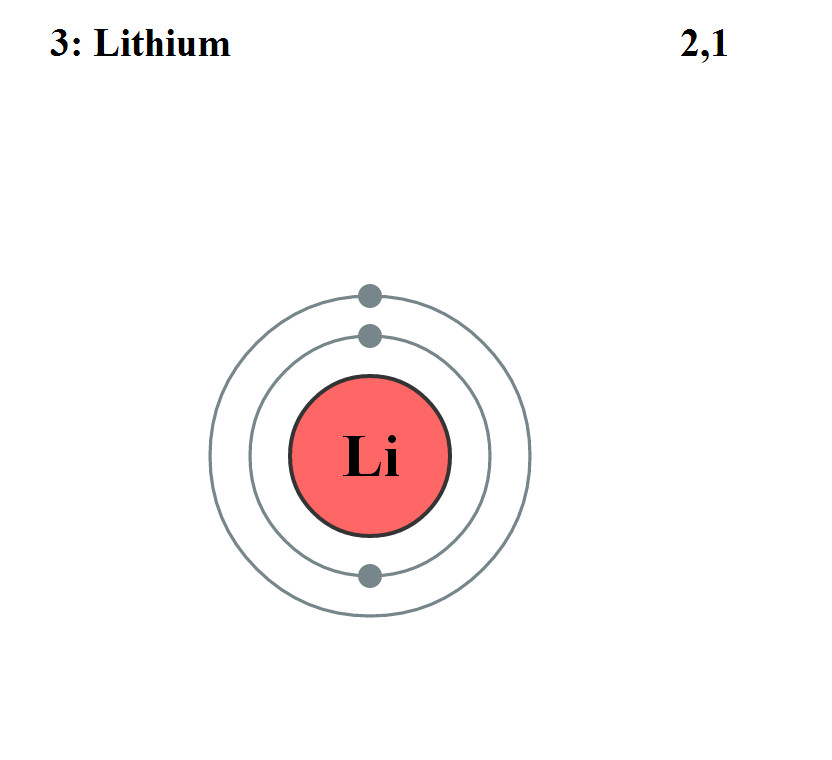
Elektronencofiguratie Bohr
2,1
Bij kamertemperatuur
vast
Elektronegativiteit
1.0
Dichtheid
534 kg m-3
Atoomstraal
152 . 10-12m
Smeltpunt
181 oC (454 K)
Relatieve atoommassa
6.941
Kookpunt
1342 oC (1615 K)
Soortelijke warmte
3582 J kg−1 K−1
Warmtegeleidingscoëfficiënt
85 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Batterij
Door de combinatie van laag gewicht met grote elektrochemische activiteit scoort lithium hoge ogen als batterijmateriaal voor mobiele toepassingen. In mobiele telefoons, camera’s en andere elektronica zijn lithiumbatterijen niet meer weg te denken.

Voor toepassing in toekomstige elektrische auto’s werken onderzoekers hard aan de ontwikkeling van betaalbare, duurzame, lichte en snel oplaadbare batterijen met een hoge energiedichtheid. Daarbij is lithium op verschillende manieren toe te passen. Bekend zijn de Li-ion batterijen van mobiele telefoons. Andere uitvoeringen zijn zogenaamde lithium-polymeer en lithium-lucht batterijen.
Pacemaker
In pacemakers is vaak een lithium-iodide batterij te vinden. Dit type heeft een relatief laag vermogen maar kan zeer langdurig elektriciteit leveren. Onder normale gebruiksomstandigheden bedraagt de levensduur zes tot tien jaar.
Lichte materialen voor lucht- en ruimtevaart
Onderdelen voor vliegtuigen en ruimtevaartuigen (bijvoorbeeld het omhulsel) moeten aan zeer strenge eisen voldoen. Idealiter combineren ze een laag gewicht aan extreme materiaaleigenschappen zoals hoge trekvastheid en een grote hardheid en breukvastheid, en dat alles ook bij bijzonder hoge temperaturen. Deze combinatie van eigenschappen is onder andere te vinden in materialen waarin lithium is verwerkt, zoals een legering die bestaat uit 14 % lithium, 1 % aluminium en 85 % magnesium.

Glas
In vuurvast glaskeramiek is tot 90% lithiumaluminiumsilicaat (LiAlSiO4) te vinden. Dit is bestand tegen extreem hoge temperaturen. Ook het zogenaamde boorsilicaat-glas is een temperatuurbestendig en sterke glassoort, onder andere voor laboratoriumtoepassingen en in uurwerken en verrekijkers. Aan deze laatste glassoort wordt lithiumoxide (Li2O) toegevoegd.
Brandstof voor stuurraket
Zeer fijn verdeeld lithium dient naar alle waarschijnlijkheid samen met waterstof of een waterstof/zuurstof-mengsel als brandstof voor de militaire luchtvaart en de ruimtevaart, vooral in stuurraketten. Daarvoor zijn ook systemen ontwikkeld met lithiumhydride (LiH) als brandstof en lithiumnitraat (LiNO3) als zuurstofbron. Vroeger werd ook lithiumchloraat (LiClO3) als oxidator gebruikt (onder andere in de Polarisraket).
Geneesmiddel
Hoewel ze doorgaans als lithium worden aangeduid zijn het zouten van lithium die als geneesmiddel worden gebruikt voor de behandeling van manische en bipolaire stoornissen. Lithiumcarbonaat (Li2CO3) wordt het meest gebruikt maar ook lithiumcitraat (Li3C6H5O7) en enkele andere zouten zijn als geneesmiddel verkrijgbaar. Het actieve ingrediënt is steeds het Li+ ion.

Meer toepassingen
Als element en in legeringen
- Katalysator (polymerisatie, ontzwaveling aardolie)
- Koud vervormbaar metaal (14 % Li, rest Mg)
- Lagermetaal, onder andere in de lucht- en ruimtevaart (0,04 % Li, 0,6 % Na, 0,7 % Ca + rest Pb)
- Moderator in een kernreactor
- Raffinage metalen, bijvoorbeeld koper en nikkel (samen met Ca)
In verbindingen
| Bereiden van tritium (voor kernfusie) | LiH |
| Toevoeging aan brandblusmiddel (om bevriezen tegen te gaan) | LiCl |
| Lenzen voor speciale optische apparatuur (UV, IR) | LiF |
| Vloeimiddel voor het solderen van Al, Mg | LiCl, LiF |
| Vuurwerk (toevoeging voor rode kleur) | LiCl, LiNO3 |
| Waarschuwingsfakkels | LiNO3 |
Naam & ontdekking
Naam
De naam lithium is afgeleid van het Griekse woord lithos, dat steen betekent. De Zweedse chemicus Jöns Jacob Berzelius stelde die naam voor omdat lithium het eerste alkalimetaal was dat in steen werd aangetroffen. Het was er aanwezig in de vorm van lithiumverbindingen (mineralen). De bekende andere alkalimetalen, zoals natrium en kalium, waren tot dan toe alleen te vinden in materialen van plantaardige of dierlijke oorsprong.
Ontdekking
De Zweedse chemicus Johan August Arfwedson isoleerde in 1817 het eerste lithium in de vorm van het zout lithiumhydroxide. Hij verkreeg dat uit het mineraal petaliet (LiAl(Si2O5)2, foto), afkomstig uit een mijn bij Uto in Zweden. Arfwedson was werkzaam in het laboratorium van Berzelius.

De eerste die puur lithiummetaal maakte was de Engelse chemicus William Thomas Brande. Hij gebruikte daarvoor elektrolyse van gesmolten lithiumoxide (Li2O). Dat proces werd al eerder door zijn vak- en landgenoot Humphry Davy gebruikt om de zuivere alkalimetalen kalium en natrium te verkrijgen.
Voorkomen
Voorkomen
Ongeveer 0,0017 % van de aardkost bestaat uit lithium; het staat op plaats 32 in de rangorde van voorkomen (op basis van gewicht). Vanwege zijn hoge reactiviteit komt het niet voor in zuivere metaalvorm.
Er zijn ongeveer 150 lithiummineralen bekend. De voornaamste zijn:
| Amblygoniet | (Li,Na)Al(PO4)(F,OH) |
| Eucryptiet | LiAlSiO4 |
| Lepidoliet | K(Li,Al) 3(Si,Al) 4O10(F,OH) 2 |
| Lithiophoriet | (Li,Al)MnO2(OH) 2 |
| Petaliet | LiAlSi4O10 |
| Spodumeen | LiAlSi2O6 |
| Trifylien | LiFe+2PO4 |
| Zinnwaldiet | KLiFe+2Al(Al,Si)3O10(F,OH) 2 |
Lithium is ook aanwezig in zeewater en in het water van grote meren, in de vorm van opgeloste zouten. Je treft het ook in diepgelegen zoutlagen aan. In de verbrandingsresten van planten (onder andere tabak) zitten sporen lithiumcarbonaat.
Winning
De belangrijkste wingebieden liggen verspreid over de hele wereld: Zimbabwe, China, Brazilië, Bolivia, de Verenigde Staten van Amerika (North-Carolina, New-England), Canada, Rusland, Chili, Democratische Republiek Congo, Australië, Oostenrijk, Spanje en Finland. De EU heeft met de Critical Raw Materials Act in 2022 het element lithium op de lijst van schaarse en strategische grondstoffen gezet.

Bereiding
Bereiding
Vroeger
De Engelse chemicus William Thomas Brande maakte het eerste pure lithiummetaal via elektrolyse van gesmolten lithiumoxide (Li2O). In 1855 lukte het de Duitser Robert Bunsen (bekend van de Bunsenbrander) samen met de Engelsman Augustus Matthiessen om het metaal in relatief grote hoeveelheden te verkrijgen. Zij pasten elektrolyse van gesmolten lithiumchloride (LiCl) toe bij een temperatuur van 610 °C. Deze technologie lag aan de basis van de eerste industriële productie door het Duitse bedrijf Metallgesellschaft AG, in 1923.
Tegenwoordig
Lithium wordt nu gewonnen uit lithiumaluminiumsilicaat, door deze stof eerst te verhitten met kaliumsulfaat (K2SO4). Er ontstaat dan onder meer lithiumsulfaat (Li2SO4). Samengebracht met natriumcarbonaat (Na2CO3) geeft deze verbinding lithiumcarbonaat (Li2CO3). Met zoutzuur ontstaat dan lithiumchloride (LiCl).
Het metaal lithium ontstaat vervolgens via elektrolyse van een gesmolten mengsel van lithium- en kaliumchloride (LiCl-KCl) bij 400 °C. Hierbij wordt gebruik gemaakt van een anode van grafiet en een kathode van ijzer.