Thallium is een zeer zacht, loodachtig metaal dat makkelijk met een mes te snijden is. Het is bijzonder giftig en wordt als het meest toxische ‘gewone’ element beschouwd (radioactieve elementen als polonium en plutonium zijn zelfs bij lagere doses al dodelijk). Thalliumsulfaat is jarenlang toegepast als rattengif.
Symbool
Tl
Protonen/elektronen
Groep
Isotopen
203Tl, 205Tl
Periode
6
Elektronenconfiguratie
[Xe] 4f145d106s26p1
Blok
p
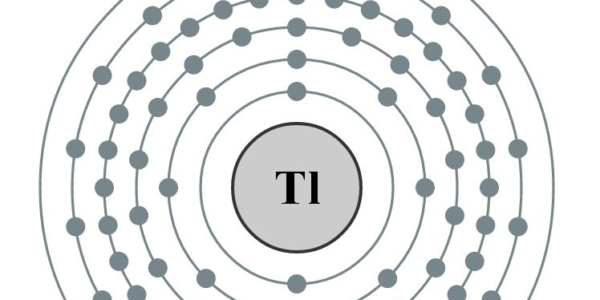
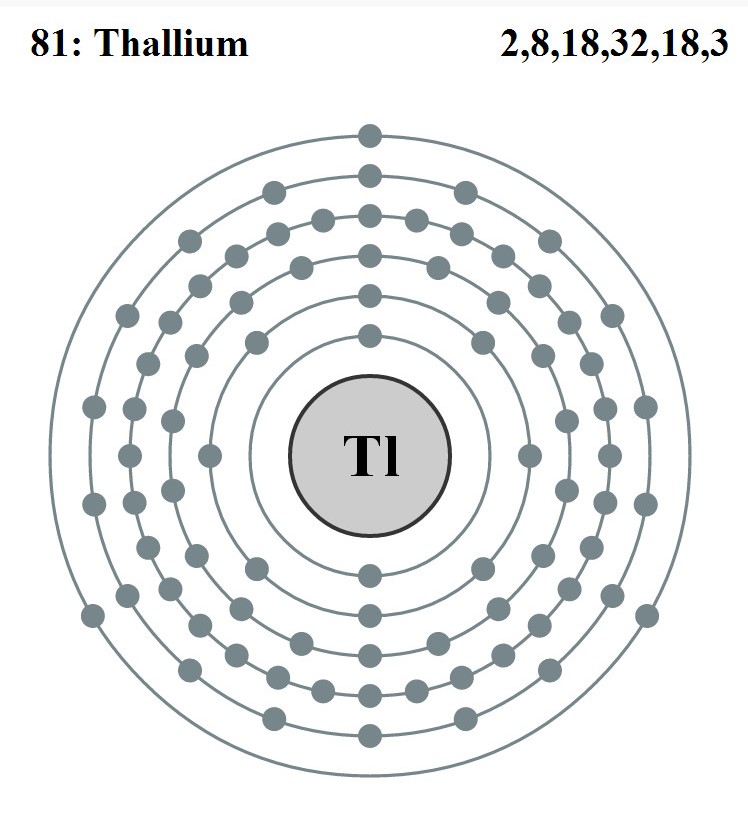
Elektronencofiguratie Bohr
2,8,18,32,18,3
Bij kamertemperatuur
vast
Elektronegativiteit
1,4 (Pauling)
Dichtheid
11800 kg m-3
Atoomstraal
171 . 10-12 m
Smeltpunt
304 oC (577 K)
Relatieve atoommassa
204.37
Kookpunt
1473 oC (1746 K)
Soortelijke warmte
129 J kg−1 K−1
Warmtegeleidingscoëfficiënt
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Infrarooddetector
Veel infraroodsensoren (zoals bewegingsdetectoren) zijn gebaseerd op het feit dat de geleidbaarheid van thalliumsulfide (Tl2S) verandert onder de invloed van infrarood licht (warmtestraling). Ook thalliumjodidekristallen zijn hiervoor geschikt.

Thermometervulling
Thermometers voor het meten van zeer lage temperaturen (tot circa -60 ºC) en bepaalde thermostaten bevatten een (eutectisch) mengsel van kwik en thallium (8,7 %). Deze apparatuur wordt gebruikt in poolstreken en in de stratosfeer.
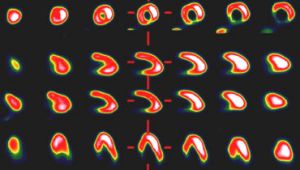
Medisch onderzoek
De isotoop thallium-201 (halveringstijd 73,5 uur) wordt gebruikt voor medisch onderzoek, bijvoorbeeld naar aandoeningen van de kransslagader en bij controle van beschadigingen aan de hartspier door zuurstofgebrek. Hiervoor gebruikt men 201Tl-chloride, dat door beschadigd of afgestorven weefsel minder snel wordt opgenomen. Dat is met gammacamera’s te traceren. Ook voor onderzoek naar schildklierafwijkingen en -kanker wordt 201Tl-chloride toegepast, meestal in combinatie met 99Tc.
Laag smeltend glas
Thalliumverbindingen zorgen er voor dat glas een zeer laag smeltpunt krijgt (ongeveer 125 – 150 ºC). Ze worden meestal toegevoegd in combinatie met seleen- en/of arseenverbindingen.
Lens infraroodcamera
Thalliumhalogenen (chloride, bromide en jodide) zijn transparant voor infrarood licht. Ze worden gebruikt in vensters bij de infraroodspectroscopie en voor de lenzen van infraroodcamera’s.
Meer toepassingen
Als element en in legeringen
- Atoomklok (zeer zuiver Tl)
- Elektrische contacten (met Ag)
- Elektrodemateriaal (met Sn en Pb)
- Gelijkrichter
- Glassoldeer
- Lagers (met Pb of Ag of Au)
- Smeltveiligheid
In verbindingen
| Contrastmiddel bij elektronenmicroscopie | TlNO3 | |||
| Fotocel en halfgeleidermateriaal | Tl2S | |||
| Geneeskunde: hersenonderzoek | 201Tl-chloride of -difosfaat) | |||
| Glas met hoge brekingsindex | Tl2O | |||
| Imitatie-edelstenen | Tl2CO3 | |||
| Remstof in de bacteriologie | Tl2SO4 | |||
| Spaarlamp | TlI | |||
| Supergeleiding bij ‘hoge’ temperatuur | CaTl2Ba2Cu2O8 / CaTl2Ba2Cu3O10 |
Naam & ontdekking
Naam
De naam thallium is afgeleid van het Griekse thallos voor ontluikende knop, uitlopende twijg of tak met loof. Deze naam is afgeleid van de karakteristieke groene kleur van één van de spectraallijnen van het element.

Ontdekking
De Britse onderzoekers William Crookes (foto) ontdekte thallium in 1861 met behulp van spectroscopische analyse van slib dat achterbleef bij de bereiding van zwavelzuur. De Franse chemicus Claude-Auguste Lamy, die het metaal in 1862 wist te isoleren, wordt ook wel als ontdekker beschouwd.
Voorkomen
Voorkomen
Thallium staat op plaats 62 in de lijst van meest voorkomende elementen van de aardkorst. Het aandeel van het element bedraagt 8,5.10-5 % (op gewichtsbasis).

De belangrijkste mineralen zijn:
| Aviceniet | Tl2O3 | |||
| Crookesiet | Cu7(Tl,Ag)Se4 | |||
| Hutchinsoniet (foto) | (Pb,Tl)2As5S9 | |||
| Lorandiet | TlAsS2 |
Thallium is ook aanwezig in zink-, koper-, lood- en ijzerertsen.
Winning
Thalliummineralen worden op bescheiden schaal gewonnen in Griekenland, het voormalig Joegoslavië en in Denemarken. Thalliumverbindingen worden ook gewonnen uit vliegas, die vrijkomt bij het roosten van zink- en loodsulfide, voornamelijk in België en Japan.
Bereiding
Bereiding
Vroeger
Thallium werd bereid door reductie met zink van thallium-verbindingen, verkregen uit het slib dat achterbleef bij de seleen bereiding en door elektrolyse van thallium-verbindingen.

Tegenwoordig
Thallium wordt nu bereid door uit de vliegas, die vrijkomt bij de lood- en zinkbereiding, thalliumverbindingen te extraheren en neer te slaan als thalliumsulfide (Tl2S), -chloride (TlCl) of -dichromaat (Tl2Cr2O7). Metallisch thallium wordt verkregen via elektrolyse van een oplossing van thalliumverbindingen.