Dit zijn opgaven 1 t/m 8 uit het eindexamen scheikunde vwo 2022 tijdvak 1.
Tenzij anders vermeld, is er sprake van standaardomstandigheden: T = 298 K en p = p0.
Groene chemie met dimethylcarbonaat
Polycarbonaat is een veelgebruikte kunststof die wordt verwerkt in de omhulsels van elektronische apparatuur en in auto’s. Begin deze eeuw werd het grootste deel van alle polycarbonaat nog geproduceerd door middel van de condensatie-polymerisatie van bisfenol-A en fosgeen. De totaalvergelijking van alle reacties in dit productieproces van polycarbonaat is in figuur 1 vereenvoudigd weergegeven.
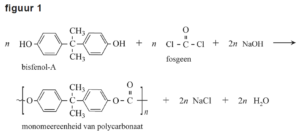
Bij dit productieproces worden de beginstoffen gemengd volgens de molverhoudingen in figuur 1. De molaire massa’s van de stoffen uit figuur 1 zijn in de tabel gegeven.
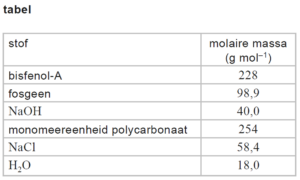
Dit productieproces heeft een rendement van 92%.