Geen zin om een filmpje te bekijken? Hieronder lees je de tekst:
Hey, ik ben Noor van de Sisters in Science en vandaag laat ik jullie zien welke elektrochemische cel je kunt verwachten in het centraal eindexamen, namelijk de waterstofbrandstofcel.
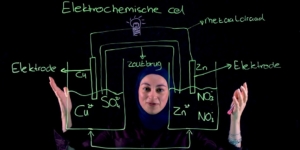
Hoe een waterstofbrandstofcel eruitziet laat ik nu zien.
Om hiermee elektriciteit op te wekken hebben we twee stoffen nodig: waterstof en zuurstof.
Waterstof moet puur worden toegevoegd omdat het snel ontvlamt en explosies kan veroorzaken.
Zuurstof daarentegen kunnen we eigenlijk toevoegen door middel van lucht in de brandstofcel te pompen.
En het enige product dat hier uitkomt is water.
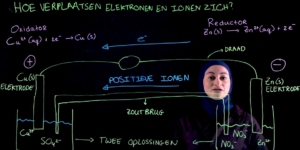
Aan de elektroden waar waterstof wordt toegevoegd vindt de volgende half reactie plaats.
Waterstof wordt opgesplitst in waterstofionen en elektronen.
Omdat er elektronen worden geproduceerd is dit dus de reductor en tijdens het ontladen is dus deze elektrode de negatieve elektrode.
Aan de andere elektrode reageert zuurstof in de volgende reactie.
Bij deze elektrode reageert dus het zuurstof met de waterstofionen en de elektronen die eigenlijk worden geproduceerd bij de reductor en dan wordt dus water gevormd.
Omdat de elektronen worden opgenomen is dit dus de oxidator en is dit dus tijdens het ontladen ook de positieve elektrode.
Tijdens de reactie gaan de elektronen van de negatieve elektrode naar de positieve elektrode.
Om deze reactie op te starten heb je dus eigenlijk waterstofionen nodig. En daarvoor moet de elektrolyt een beetje zuur zijn.
Door zuur zijn er eigenlijk dus H-plusjes aanwezig, die eigenlijk ervoor zorgen dat deze reactie kan beginnen.
En deze reactie wordt eigenlijk verder gevoed omdat er bij de reductor al waterstofionen worden geproduceerd.
Nou, in het kort is dit dus de brandstofcel die je eigenlijk kan verwachten in je centraal examen, de waterstofbrandstofcel.
Hier wordt eigenlijk waterstof en zuurstof toegevoegd om elektronen te produceren door deze half reacties te laten verlopen.
Het enige product dat dus vrijkomt is water en dit dus eigenlijk een groene manier om elektriciteit op te wekken.
Vond je dit nou interessant en wil je meer weten over redoxreacties? Kijk dan onze uitlegfilmpjes op exactwatjezoekt.nl.
Hi, wij zijn Lotte, Noor en Mimi van de Sisters in Science. Wil je meer van ons weten, volg ons dan op Instagram @sistersinscience_NL.