Geen zin om een filmpje te bekijken? Hieronder lees je de tekst:
Hey, ik ben Noor van de Sisters in Science. In dit filmpje laat ik zien welke componenten aanwezig zijn in een elektrochemische cel.
Elektrochemische cellen komen in vele soorten voor.
Bijvoorbeeld als in een batterij of in een accu.
En het doel daarvan is het leveren van elektrische energie.
In een elektrochemische cel vindt een redoxreactie plaats.
Dat betekent dat er elektronen vrijkomen of opgenomen worden.
En het verplaatsen van elektronen zorgt ervoor dat je elektrische energie hebt.
De elektrochemische cellen die je in de scheikundelessen tegenkomt zijn eigenlijk vele malen groter dan je standaard AA-batterij.
Hoe ziet een elektrochemische eruit?
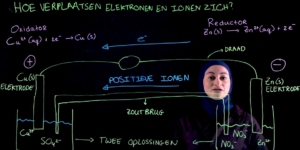
We beginnen met het tekenen van twee bakken.
In die twee bakken zitten zoutoplossingen.
En vaak worden in de scheikundeopgave gegeven welke zoutoplossingen gebruikt worden.
Dan kan kopersulfaat zijn, als voorbeeld. Of zinknitraat.
In de ene bak worden elektronen geproduceerd en in de andere bak worden elektronen opgenomen.
Maar dit kan alleen als er elektrodes in de oplossing steken.
Nou, elektrodes zijn metalen staven , bijvoorbeeld een koperstaaf of een zinkstaaf.
Dit is een koperstaaf en dit is een zinkstaaf.
In beide bakken vinden dus half reacties plaats van de totale redoxreactie.
Wanneer een elektrochemische cel energie levert, noemen we dat ontladen.
Tijdens het ontladen worden één van de elektrodes een positieve elektrode en de andere een negatieve elektrode.
Om te bepalen welke positief is en welke negatief, moeten we kijken naar de stroom van de elektronen of naar de half reacties die plaatsvindt in een elektrochemische cel.
Maar dit bespreken we niet in dit filmpje.
Kijk daarvoor naar het filmpje ‘Waar is de positieve elektrode en waar is de negatieve elektrode.’
We gaan terug naar onze elektrochemische cel.
We moeten ervoor zorgen dat de elektronen van de ene bak kunnen bewegen naar de andere bak.
En dat kan alleen maar door iets dat stroom geleid. Bijvoorbeeld een metalen draad.
En een metalen draad verbindt de elektrodes.
Nou, nu hebben we een elektrochemische cel in elkaar gezet, maar dit levert geen stroom, want er is geen gesloten stroomkring.
Om dit te verhelpen, voegen we een zoutbrug toe.
Een zoutbrug is eigenlijk een buisje met een gel, met een zoutoplossing.
Deze zoutoplossing reageert niet met de elektrochemische cel, maar zorgt ervoor dat de elektronenlading gecompenseerd wordt.
Tadaa! We hebben nu een elektrochemische getekend die stroom oplevert.
Nu kan je je lampje branden, of je telefoon opladen.
Even kort samengevat, voor een elektrochemische cel heb je de volgende componenten nodig.
Twee bakjes met zoutoplossingen, twee elektrodes, een metalen draad die de elektrodes verbindt en een zoutbrug die de zoutoplossingen verbindt.
Wil je meer weten over de werking van een elektrochemische cel? Kijk dan onze andere filmpjes over de elektrochemische cel op exactwatjezoekt.nl.
Hi, wij zijn Lotte, Noor en Mimi van de Sisters in Science. Wil je meer van ons weten, volg ons dan op Instagram @sistersinscience_NL.