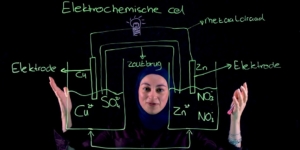
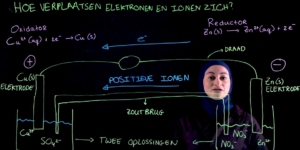
Geen zin om een filmpje te bekijken? Hieronder lees je de tekst:
Hoi, ik ben Lotte van de Sisters in Science en vandaag ga ik jou laten zien waaruit een atoom bestaat en hoe je die tekent.
Een atoom is opgebouwd uit drie deeltjes, namelijk protonen, neutronen en elektronen.
Wat nou heel belangrijk is om te onthouden bij die drie deeltjes, is de massa en of ze lading hebben.
Laten we dat even gaan samenvatten in een tabel.
Ik heb een tabel getekend waar we dus de massa en de lading overzichtelijk kunnen maken van die drie deeltjes.
Laten we beginnen met de protonen.
Protonen hebben een massa van 1 u en een positieve lading.
Dan het volgende deeltje, dat zijn de neutronen.
Neutronen hebben ook een massa van 1 u maar hebben geen lading, dus zijn neutraal.
En dan tot slot de elektronen.
Nou, wat zo leuk is aan de elektronen, die zijn zo licht, dat we mogen aannemen dat ze geen massa hebben.
Maar wat ze wel hebben is een negatieve lading.
Op je eindexamen kan je worden gevraagd om het atoommodel te tekenen van een specifiek element.
Nou, wat ervoor nou belangrijk is om te weten, is dat de kern van een atoom bestaat uit protonen en de neutronen.
Als je nou wilt uitvogelen hoeveel protonen er in de kern van een atoom zitten, gaan we kijken naar het periodiek systeem in je Binas.
Het aantal protonen is namelijk gelijk aan het atoomnummer.
Hier heb ik een hashtag getekend en die hashtag betekent aantal.
Dus wat hier staat is dat het aantal protonen gelijk is aan het atoomnummer.
Wat er nou zo interessant is aan het aantal protonen is dat het bepaald met welk atoom, dus welk element, je te maken hebt.
Maar dit werkt ook andersom.
Als je nou weet welk element je hebt, of welke atoom, kun je ook opzoeken hoeveel protonen er in die kern zitten, dus welk atoomnummer het heeft.
Met het aantal protonen kunnen we ook aantal neutronen in een atoom bepalen.
Dat gaan we namelijk doen met het massagetal.
Want de massa van een atoom wordt namelijk bepaald door het aantal protonen en het aantal neutronen.
Want we gaan er in dit model vanuit dat de massa van de elektronen verwaarloosbaar is.
Neem bijvoorbeeld fluor.
Fluor heeft negen protonen en we kunnen in de Binas zien dat het een atoommassa van negentien heeft.
En negentien min negen is dus tien neutronen.
Hier staat dus dat het aantal neutronen gelijk is aan het massagetal min het aantal protonen.
Nu komen we bij het laatste onderdeel, namelijk het aantal elektronen in het atoom.
Wat hier belangrijk is om te weten is of het atoom een lading heeft.
De lading wordt namelijk veroorzaakt door het aantal elektronen in het atoom.
Als een atoom meer elektronen heeft dan protonen, heeft het bijvoorbeeld een negatieve lading.
Heeft het nou meer protonen dan elektronen, heeft het een positieve lading.
En is het aantal elektronen gelijk aan het aantal protonen, heeft het atoom geen lading en is het neutraal.
Laten we even gaan kijken naar een voorbeeld.
Cl min, het negatief geladen ion van het chlooratoom.
Chloor heeft zeventien protonen, dat kun je zien in het periodiek systeem van je Binas.
Het heeft namelijk een atoomnummer van zeventien.
Als chloor geen lading heeft, dus neutraal is, zou chloor ook zeventien elektronen hebben.
Maar nu hebben we te maken met die min lading.
Hoe je er nou achter kan komen hoeveel elektronen er in dat atoom zitten, is door het aantal protonen min de lading te doen.
Dat ziet er zo uit in het geval van chloor.
Hier zie je dus het aantal protonen, namelijk zeventien, min de lading.
Hier hebben we een som waar min min staat, dat wordt een plus.
Dat betekent dat chloor, het negatief ion van chloor, Cl min, dus achttien elektronen heeft.
De regel die je dan dus kan gebruiken is dat het aantal elektronen gelijk is aan het aantal protonen min de lading.
Onthoud hierbij goed dat als het een minlading heeft dat je die min mee moet nemen in de som.
Waar bevinden die elektronen zich in dat atoommodel?
Nou die vliegen om die kern heen.
Dat kun je een beetje zien als de aarde die rondom de zon vliegt, of de maan om de aarde.
Die elektronen bevinden zich op vaste afstanden van de kern en dat noemen wij schillen.
Nou, hoeveel elektronen passen er nou in die verschillende schillen?
Dat verschilt per schil.
In die eerste schil passen twee elektronen, in de tweede en derde passen er acht.
Nou zijn er nog meer schillen, maar die gaan we nu niet behandelen.
Als je dat wilt weten, dan moet je scheikunde gaan studeren.
Als je elektronen gaat tekenen, dan begin je in de eerste schil, dus die ga je als eerst vullen, daar passen er twee in.
Is die nou gevuld, ga je door naar de derde, is die gevuld, ga je door naar de vierde, enzovoorts.
Laten we dat even gaan doen aan de hand van een voorbeeld.
En laten we even doorgaan met dat eerdere voorbeeld, namelijk het negatieve geladen ion van chloor, Cl min.
We hadden net bepaald dat door 18 elektronen inzaten.
Dus laten we die even gaan verdelen over die schillen.
In de eerste passen er twee.
In de tweede passen er acht.
Nu zitten we dus op twee plus acht is 10 elektronen.
Hebben we er nog acht over, die passen precies in de derde schil.
Hier zien we dus uit dat die achttien elektronen van dat chloor min ion verdeeld zijn over die drie schillen.
Laten we alles nog even kort samenvatten.
Een atoom bestaat dus uit drie deeltjes, namelijk protonen, neutronen en elektronen.
In die kern bevinden zich de protonen en de neutronen.
Protonen hebben een massa van 1 u en een positieve lading.
En neutronen hebben ook een massa van 1 u maar hebben geen lading.
Wil je nou weten hoeveel protonen er in die kern zitten, dan ga je kijken naar het atoomnummer in het periodiek systeem van de Binas.
Wil je nou weten hoeveel neutronen er in die kern zitten, dan trek je van het massagetal het aantal protonen af.
Elektronen die vliegen om die kern heen en bij elektronen mogen we ervan uitgaan dat ze geen massa hebben.
Maar ze hebben wel een negatieve lading.
Het aantal elektronen bepaal je door het aantal protonen min de lading te doen.
Die elektronen die vliegen dus op vaste afstanden van die kern en dat noemen we schillen.
In de eerste schil passen twee elektronen, in de tweede en de derde schil passen acht elektronen.
Er zijn er meer, maar die gaan we nu niet behandelen.
Vond je dit nou behulpzaam, kijk dan onze andere filmpjes over atomen, moleculen en bindingen op exactwatjezoekt.nl.
Hi, wij zijn Lotte, Noor en Mimi van de Sisters in Science. Wil je meer van ons weten, volg ons dan op Instagram @sistersinscience_NL.