Beryllium is een zeer licht, stabiel loodgrijs aardalkalimetaal. Het beschikt over goede mechanische eigenschappen over een breed temperatuurgebied. Beryllium kent vele high-tech toepassingen zoals in de spiegels voor de James Webb ruimtetelescoop. Het is het kleinste element dat alleen stabiel is met meer neutronen dan protonen in de kern. Daardoor was het een soort ‘bottleneck’ in de vorming van nieuwe elementen vlak na de oerknal. Aquamarijn en smaragd zijn edelstenen van het berylliumhoudende mineraal beril. Beryllium kan twee elektronen afstaan en Be2+ vormen. Ingeademd metaalstof of -poeder is erg giftig, net zoals vrijwel alle verbindingen met beryllium.
Symbool
Be
Protonen/elektronen
Groep
Isotopen
9Be
Periode
2
Elektronenconfiguratie
[He] 2s2
Blok
s
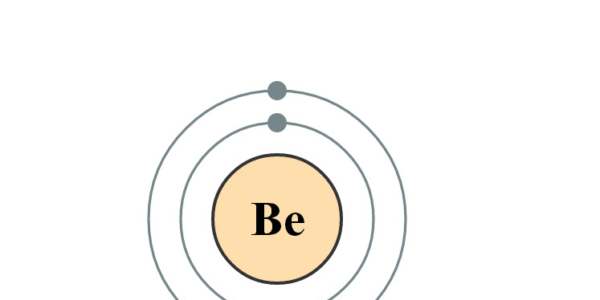
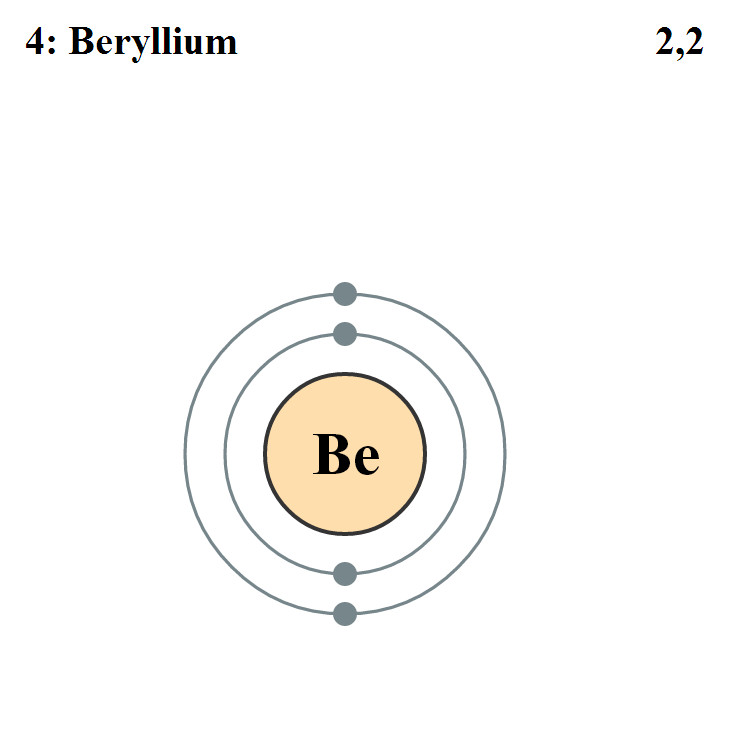
Elektronencofiguratie Bohr
2,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,5 (Pauling)
Dichtheid
1850 kg m-3
Atoomstraal
112 10-12m
Smeltpunt
1287 oC (1560 K)
Relatieve atoommassa
9.0122
Kookpunt
2471 oC (2744 K)
Soortelijke warmte
1800 J kg-1K-1
Warmtegeleidingscoëfficiënt
170 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Spiegels ruimtetelescoop
Beryllium combineert een laag gewicht met hoge mechanische stabiliteit bij lage temperaturen. Daarom zijn de spiegels van de James Webb ruimtetelescoop gefabriceerd uit beryllium (voorzien van een goudcoating). De telescoop zal vanaf 2018 de bekende Hubble telescoop opvolgen. De primaire spiegel (doorsnede: 6,3 meter) is opgebouwd uit achttien zeshoekige berylliumdelen.

High tech toepassingen
De ruimtetelescoop is een typisch voorbeeld van een product waar prestatie boven prijs gaat. Zo zijn er meer toepassingen voor beryllium in defensie en in lucht- en ruimtevaart. Het materiaal wordt er gebruikt voor lichtgewicht structurele onderdelen en hitteschilden in supersonische vliegtuigen, geleide raketten, de Space Shuttle en in satellieten.
Röntgenbuisvenster
Vanwege de lage elektronendichtheid laat beryllium goed röntgenstralen door. Dat maakt het metaal geschikt voor toepassing als venster in röntgenbuizen. Zo’n venster moet sterk genoeg zijn om het vacuüm in stand te houden, maar dun genoeg om de straling door te laten. Vergeleken met aluminium, ook een licht en sterk constructiemateriaal, is de röntgentransparantie een factor 17 beter.

(Horloge)veer
Een legering van koper met 2% beryllium en 0,4% nikkel of kobalt is antimagnetisch en zeer slijtvast. Het is daardoor zeer geschikt voor toepassing als horlogeveer.
Vonkvrij gereedschap
Legeringen van koper met een paar procent beryllium zijn bijzonder geschikt voor de vervaardiging van vonkvrij slaggereedschap, bijvoorbeeld voor gebruik in een vuurwerkfabriek of olieraffinaderij. Dergelijke legeringen zijn niet-magnetisch, slijtvast en goed bestand tegen oxidatie. De eigenschappen zijn vergelijkbaar met die van het hardste staal.

Luidspreker
Het lage gewicht en de grote stijfheid van beryllium maken het geschikt voor gebruik als hogetonenluidspreker (tweeter). Nadelen zijn daarbij de prijs, de relatief slechte bewerkbaarheid (het is vrij bros) en het mogelijk giftige bewerkingsafval. Je vindt beryllium daarom vooral in top-luidsprekersystemen voor thuisgebruik en in professionele toepassingen.
Meer toepassingen
Als element en in legeringen
- Legering met ca. 50% Ti: Compressor, schoepas
- Hoogwaardige legeringen met Hf, Ta, Nb en W
- Moderator (neutronenremmer) in kerncentrales
- Roestvrij staal (kleine hoeveelheden in Ni- en Cr-houdend staal)
- Rotorbladen voor helikopters
In verbindingen
| Fluorescentielamp | BeO |
| Gaslampen | Be(NO3)2 |
| Glas | BeF2 |
| Glas dat UV- en röntgenstralen doorlaat | LiBeB4O7 |
| Keramisch materiaal voor (vliegtuig)bougies | BeO |
| Keramisch materiaal voor ruimtevaart (o.a. hittebestendige tegels) | BeO |
Naam & ontdekking
Naam
De naam beryllium is afgeleid van het Griekse woord berullos, dat zeegroen betekent. Dat is de kleur van de edelsteen smaragd, een van de varianten van het mineraal beril. Het woord ‘bril’ is ook afkomstig van beril: de eerste brillenglazen werden (in de middeleeuwen) van dit doorzichtige mineraal gemaakt.
Ontdekking
De Franse chemicus Nicolas-Louis Vauquelin (foto) isoleerde in 1798 berylliumoxide (BeO) uit het mineraal beril (beryllium aluminium silicaat: [Be3Al2(SiO3)6]). Het oxide bleek andere eigenschappen te hebben dan de oxiden van destijds bekende elementen, zodat Vauquelin concludeerde met een nieuw element van doen te hebben.

In 1828 kregen de chemici Friedrich Wöhler en Antoine Alexandre Brutus Bussy onafhankelijk van elkaar beryllium in handen, via de reactie van berylliumchloride (BeCl2) met kalium in een platina smeltkroes.
Voorkomen
Voorkomen
Beryllium is in de aardkorst te vinden in de vorm van mineralen. Het staat 48 op de lijst van meest voorkomende elementen, met een aandeel van 2,8.10-4 % op gewichtsbasis.

De belangrijkste berylliumhoudende mineralen zijn:
- Beril (foto) Be3Al2Si6O18 (groen: smaragd, blauw: aquamarijn)
- Bertrandiet Be4Si2O7(OH)2
- Berilloniet Be3SiO4(OH) 2.2H2O
- Chrysoberil BeAl2O4
- Euklaas BeAlSiO4(OH)
- Fenakiet Be2SiO4
- Hambergiet Be2BO3(OH)
Winning
De belangrijkste wingebieden liggen in de Verenigde Staten van Amerika, Rusland, Rwanda, Canada, Argentinië, Brazilië, Colombia, India, Madagaskar, Mozambique, Oeganda, Zambia, Zimbabwe, Zuid-Afrika en Namibië. De EU heeft met de Critical Raw Materials Act in 2022 het element beryllium op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
Het allereerste berylliuym werd bereid via de reactie van berylliumchloride (BeCl2) met kalium in een platina smeltkroes.
Tegenwoordig
De industriële productie van nu begint met het smelten van berilerts bij 1500 -1600 ºC. De smelt wordt in water uitgegoten, vermalen en geëxtraheerd met geconcentreerd zwavelzuur (H2SO4). Wat rest is voornamelijk een mengsel van aluminium- en berylliumsulfaat. Behandeling met ammonia leidt tot de vorming van berylliumhydroxide en opeenvolgende verhitting tot berylliumoxide.
De volgende stap is hier berylliumfluoride van te maken, dat als grondstof dient voor elektrolyse. Daarbij ontstaat metallisch beryllium uit een mengsel van gesmolten beryllium- en natriumfluoride (NaBeF3) met een positieve pool (anode) van koolstof en een negatieve pool (kathode) van nikkel.

Uit berylliumfloride is ook beryllium te verkrijgen door reductie met magnesium bij 900 ºC.
Een derde mogelijkheid biedt het chlorideproces. Daarbij wordt beril bij 800 ºC omgezet in berylliumchloride volgens
waarna elektrolyse van gesmolten berylliumchloride plaatsvindt.