Promethium is een niet stabiel, radioactief element uit de reeks van de zeldzame aarden. Het komt op aarde alleen ‘natuurlijk’ voor als verval product van europium- en uraniumisotopen. Volgens schattingen is er op enig moment maximaal 600 gram promethium aanwezig. Het isotoop promethium-147, gewonnen uit splijtstof voor kernreactoren, kan als nucleaire energiebron voor de ruimtevaart dienen. Vanwege de radioactiviteit van promethium vertonen zouten van het metaal luminescentie: ze ‘gloeien’ in het donker met een vaalblauwe of -groene kleur. Dat duurt niet heel lang: de halfwaardetijd is een schamele 2,6 jaar.
Symbool
Pm
Protonen/elektronen
Groep
Isotopen
145Pm, 147Pm
Periode
6
Elektronenconfiguratie
[Xe] 6s2 4f5
Blok
f
Elektronencofiguratie Bohr
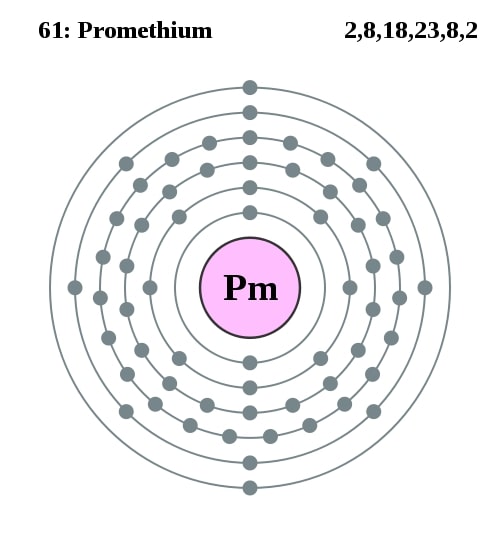
2,8,18,23,8,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,2 (Pauling)
Dichtheid
7260 kg m-3
Atoomstraal
183 10-12m
Smeltpunt
1068 oC (1341 K)
Relatieve atoommassa
145
Kookpunt
2730 oC (3003 K)
Soortelijke warmte
180 J kg-1K-1
Warmtegeleidingscoëfficiënt
17,9 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Nucleaire batterij
Promethium-147 is de enige isotoop waarvan toepassingen mogelijk zijn. De instabiele promethiumkernen in deze isotoop kennen bètaverval. Daarbij verandert een neutron in de kern in een proton onder het uitzenden van een elektron (en een antineutrino).
Nucleaire batterijen gebruiken de hoogenergetische elektronen van de bèta-straling voor het leveren van stroom. Daarvoor wordt een kleine promethiumbron tussen twee halfgeleiders ge’sandwiched’. Zulke batterijen hebben een levensduur van ongeveer vijf jaar.
Het ook mogelijk de warmte van het bètaverval via het thermo-elektrisch effect in elektrische energie om te zetten, bijvoorbeeld met thermo-elementen van loodtelluride of kobaltsilicide. Dit levert een zeer lichte energiebron, geschikt voor gebruik in ruimtevaartuigen en satellieten. De levensduur van deze batterijen bedraagt ongeveer 10 jaar.

Diktemeter
De straling van promethium-147 is ook te gebruiken om de dikte van materialen te meten. De adsorptie van de straling is dan een maat voor de dikte van het materiaal. Dit wordt onder andere toegepast bij het meten van de dikte van de plastic coating op metalen.
Meer toepassingen
In verbindingen
- blauw/groen luminescerend materiaal, o.a. voor horloges en in ruimtevaart (mengsel van 147Pm2O met een fosfor, bijv. ZnS/Cu2+).
- Onderzoek naar beschadigingen aan vliegtuigwanden.
Naam & ontdekking
Naam
Het element promethium is vernoemd naar Prometheus, een titaan uit de Griekse mythologie. Hij stal het vuur uit de hemel om het de mensen tot nut te laten zijn. De naam, voorgesteld door Grace Mary Coryell (de vrouw van één van de ontdekkers), refereert aan de geweldige inspanningen die vereist waren om (verbindingen van) dit element te isoleren.
Ontdekking
Al in 1902 werd het bestaan van promethium voorspeld. Het duurde ruim veertig jaar voordat het werkelijk werd gevonden. In 1945 toonden de Amerikanen Jacob A. Marinsky, Lawrence E. Glendenin and Charles D. Coryell het aan in de splijtingsproducten van uranium uit een grafietreactor. Pas na de Tweede Wereldoorlog, in 1947, publiceerden ze hun resultaten. Ze scheidden het promethium van de andere reactieproducten met behulp van ionenwisseling en vloeistofchromatografie.
Voorkomen
Voorkomen
Promethium komt in de aardkorst in extreem kleine geringe hoeveelheden voor. Het is onder andere aanwezig in pekblende (uraniumerts) omdat het onderdeel uitmaakt van de vervalreeks van uranium. Volgens schattingen is er in alle aardse voorraden van uranium in totaal ongeveer 560 gram promethium aanwezig. Een andere ‘bron’ van promethium is europium, dat ‘verantwoordelijk’ is voor ongeveer 12 gram. Ook treft men het aan in apatiet, waarschijnlijk als product van de omzetting van neodymium door neutronen afkomstig van kosmische straling.
Promethium is eveneens aangetoond in het spectrum van ster HR 465 in de Andromeda-nevel.
Bereiding
Bereiding
Promethium is op de schaal van een kilogram te bereiden bij de opwerking van splijtstofstaven uit kernreactoren. Het wordt daarbij achtereenvolgens omgezet in oxide en chloride. Via reductie met calcium is het als vrij zuiver metaal te verkrijgen.