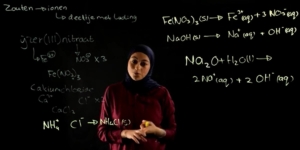Geen zin om het filmpje te kijken? Hieronder lees je de tekst:
Hoi, Ik ben Lotte van de SistersinScience_NL en vandaag ga ik je laten zien wat het verschil is tussen de oxidator en de reductor in redoxreacties.
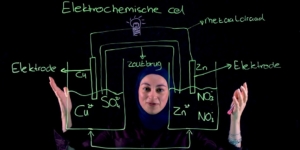
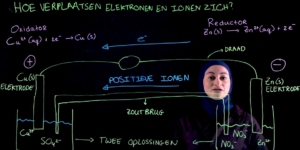
Redoxreacties zijn reacties waarbij elektronen worden overgedragen.
In een redoxreactie hebben we een reductor en een oxidator.
Het belangrijkste om te weten over de oxidator is dat deze elektronen opneemt.
Dit is ook meteen een handig ezelsbruggetje. De oxidator neemt elektronen op.
De reductor daarentegen doet precies het tegenovergestelde die staat elektronen af.
Goed, de oxidator die neemt dus elektronen op. In een reactievergelijking ziet het er zo uit.
In de halfredactie van een oxidator staan de elektronen dus voor de pijl.
Voor de reductor is het dus weer precies allemaal omgedraaid. De reductor staat elektronen af, dus de halfreactie ziet er als volgt uit.
Bij de halfreactie van de reductor kunnen we dus zien dat er elektronen worden afgestaan en dat er een oxidator ontstaat.
Hier zien we ook dat de elektronen na de pijl staan.
Een overzicht van oxidator en en reductoren kun je vinden in Binas tabel 48. Hier staat een lijst met allemaal halfreacties.
Hier zie je de eerste 5 rijen uit deze Binas tabel. Lezen we deze halve reacties nou af van links naar rechts, dan hebben we het over de hoofdredacties van de oxidatoren, maar lezen we ze nou af van rechts naar links, dan hebben we het over de halfreacties van de reductoren.
Nou, heel belangrijk is om te weten over deze tabel, is dat een sterke oxidator en bovenaan de tabel staan.
Een sterke oxidator betekent automatisch een slechte reductor, dus de slechte reductoren staan ook bovenaan in de Binas tabel.
Dit betekent ook dat de beste sterkste reductoren helemaal onderaan de Binas tabel staan.
Hoe gebruik je deze tabel nou bij het opschrijven van redoxreacties?
Wil je de halfreactie van een oxidator overnemen? Dan neem je hem over van links naar rechts, dan staan de elektronen voor de pijl en gaat het dus over de halfreactie van een oxidator. Bij de reductoren is dat weer precies andersom.
Wil je nou de halfreactie van reductor overnemen? Dan neem je hem over van rechts naar links.
Dan staan de elektronen na de pijl en gaat het om de halfreactie van de reductor.
Laten we het nog even kort samenvatten.
- Een oxidator neemt dus elektronen op. Dat was gelijk ons ezelsbruggetje.
- In de halfreactie van een oxidator staan de elektronen voor de pijl en in deze halfreactie ontstaat een reductor.
- In Binas tabel 48 lees je de halfreacties af van links naar rechts
- en staan de sterkste oxidator en bovenaan de lijst.
Bij reductoren was het precies andersom.
- Reductoren staan elektronen af.
- In de halfreactie staan de elektronen na de pijl en ontstaat er een oxidator.
- In Binas tabel 48 lees je de halfreacties af van rechts naar links
- en staan de sterkste reductoren onderaan.
Vond je dit nou super interessant?
En wil je weten hoe je met die halfreacties de totaal vergelijking van een redoxreactie kan opstellen?
Kijk dan ons filmpje totaal vergelijking opstellen op Exactwatjezoekt.nl.
Wij zijn Noor Lotte en mimi van een SistersinScience_NL.
Wil je meer van ons zien? Volg ons dan op Instagram op SistersinScience_NL.