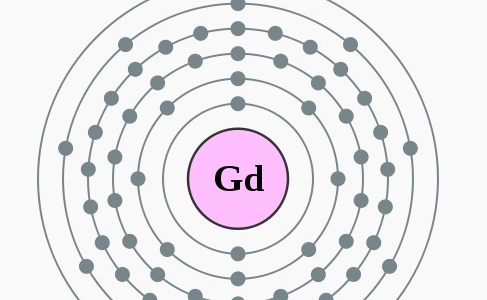
Gadolinium is een zilverwit glimmend metaal uit de reeks van de zeldzame aarden. Gadolinium heeft de grootste werkzame doorsnede voor het invangen van thermische neutronen. Het is vrij stabiel in lucht maar vormt onder de invloed van vocht een gemakkelijk te verwijderen oxidehuid. Het is magnetisch bij kamertemperatuur (twintig graden Celsius) maar verliest zijn magnetisme als je het in je hand opwarmt.
Symbool
Gd
Protonen/elektronen
Groep
Isotopen
152Gd, 154Gd, 155Gd, 156Gd, 157Gd, 158Gd, 160Gd
Periode
6
Elektronenconfiguratie
[Xe] 4f75d16s2
Blok
f
Elektronencofiguratie Bohr
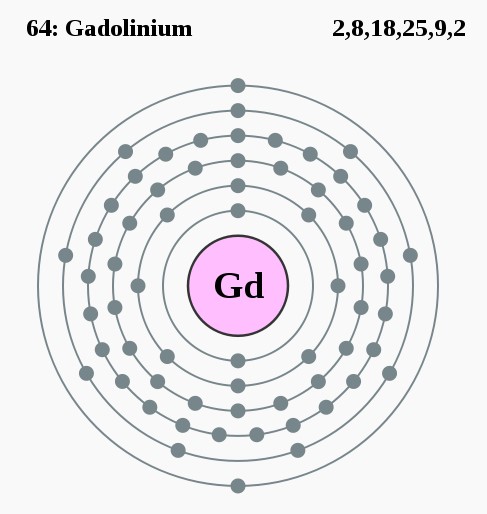
2,8,18,25,9,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,2 (Pauling)
Dichtheid
7900 kg m-3
Atoomstraal
179 . 10-12 m
Smeltpunt
1313 oC (1586 K)
Relatieve atoommassa
157.25
Kookpunt
3273 oC (3546 K)
Soortelijke warmte
235 J kg−1 K−1
Warmtegeleidingscoëfficiënt
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Permanente magneet
Legeringen van zeldzame aarden met metalen als ijzer, kobalt, nikkel en aluminium worden onder andere gebruikt voor permanente magneten. De goede magnetische eigenschappen zijn het gevolg van de aanwezigheid van (meerdere) ongepaarde elektronen.
Met gadoliniumnitride (GdN) wordt geëxperimenteerd als basis voor sterke, grote permanente magneten.
MRI contrastmiddel
Oplosbare verbindingen met gadolinium (bv organische complexen) dienen als contrastvloeistof bij Magnetic Resonance Imaging (MRI). Vanwege de ongepaarde elektronen van het gadolinium zijn ze goed zichtbaar op de scan. Zo is het bijvoorbeeld mogelijk delen van de bloedsomloop zeer scherp af te beelden en vernauwingen, blokkades of lekkages te detecteren. Na afloop van het onderzoek wordt het complex geleidelijk door de nieren uitgescheiden.
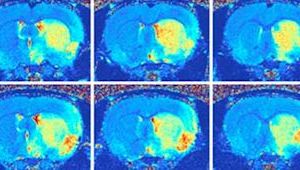
Kankeronderzoek
Voor kankeronderzoek zijn verbindingen met gadolinium ontwikkeld die zich met enige voorkeur in kankerweefsel nestelen. Zo zijn mogelijk (beginnende) tumoren op te sporen met een MRI-scan.
Chroomstaal
Toegevoegd (tot 1%) aan legeringen van chroom en ijzer zorgt gadolinium voor een verbetering van de verwerkingseigenschappen en de temperatuur- en oxidatiebestendigheid.

Neutronenvanger
Gadolinium wordt soms toegevoegd in de splijtstofstiften voor kernreactoren om de hoge initiële reactiviteit te dempen. Hierbij wordt gebruik gemaakt van de uitzonderlijk hoge werkzame doorsnede van de oneven gadoliniumisotopen 155 en 157 voor het invangen van thermische neutronen. Is eenmaal een thermisch neutron ingevangen dan veranderen deze isotopen in exemplaren met een even massagetal. Omdat die een veel minder grote werkzame doorsnede hebben, wordt het dempende effect na verloop van tijd vanzelf kleiner.
Meer toepassingen
In verbindingen
| Fosforescerende stof in TL-buizen | (Tb,Ce,Gd,Mg)BO3 |
| Imitatiediamant | Gd3Ga5O12 |
| Keramisch stralingsschild | Gd2O3 |
| Magnetrons (microgolfovens) | Gd3Ga5O12, Y3Al5O12 met Gd |
| Masers (lasers in microgolfgebied) | Gd-ethylsulfaat |
| Scintillatieteller | Gd2O2S |
| Supergeleiding | Gd2(MoO4)3, GdBa2Cu3O7 |
Naam & ontdekking
Naam
De naam gadolinium is een eerbetoon aan de Finse chemicus en geoloog Johan Gadolin. Die ontdekte in 1794 een mineraal dat de weg opende naar de ontdekking van de zeldzame aarden. Ook dit mineraal werd later naar hem vernoemd: gadoliniet.
Ontdekking
De Zwitserse chemicus Jean Charles Galissard de Marignac (foto) ontdekte gadolinium in 1880 via spectraalanalyse van de mineralen gadoliniet en ceriet. Hij slaagde er in uit het laatste mineraal gadoliniumoxide te isoleren, dat hij gadolinia noemde. Het bestaan van het element werd zes jaar later bevestigd door de Franse chemicus Paul Emile Lecoq de Boisbaudran. Hij slaagde er ook in metallisch gadolinium te isoleren.

Voorkomen
Voorkomen
Gadolinium staat op de 41e plaats in de lijst van de meest voorkomende elementen in de aardkorst. Het heeft een aandeel van 6,2.10-4 % op gewichtsbasis.

De belangrijkste mineralen met kleine hoeveelheden van dit element zijn
| Allaniet-(Ce) | (Ce, Ca,Y)2(Al,Fe+2, Fe+3)3 (SiO4)3 OH |
| Allaniet-(Y) | (Y,Ce,Ca)2(Al,Fe+3)3(SiO4)3 OH |
| Bastnaesiet-(Ce) | (Ce,La)CO3F |
| Bastnaesiet-(Y) | (Y,La)CO3F |
| Gadoliniet-(Ce) (foto) | (Ce,La,Nd,Y)2Fe+2,Be2Si2O10 |
| Gadoliniet-(Y) | Y,Fe+2,Be2Si2O10 |
| Lanthaniet-(Ni) | (Nd,La)2(CO3)3.8H2O |
| Monaziet-(Ce) | (Ce,La,Nd,Th)PO4 |
| Monaziet-(La) | (La,Ce,Nd)PO4 |
| Samarskiet-(Y) | (Y,Ce,U,Fe+2)3(Nb,Ta,Ti)5O16 |
Winning
De belangrijkste wingebieden liggen in Australië, China, Mongolië, India, Brazilië, de Verenigde Staten van Amerika, Maleisië, Rusland, Tanzania, Burundi, Zambia, Madagaskar, Noorwegen, Zweden en Canada.
Bereiding
Bereiding
Vroeger
Zeldzame aarden werden oorspronkelijk gescheiden op grond van de uiterst kleine verschillen in oplosbaarheid van de metaalhydroxiden en -oxiden in loog. Ook bleek het mogelijk te scheiden op basis van de oplosbaarheid van hun zouten, voornamelijk de oxalaten en sulfaten (met name Ln2(SO4)3.Na2SO4.xH2O, met Ln als symbool voor de lantaniden). De oplosbaarheid neemt licht toe naarmate de atoommassa van het lanthanide toeneemt.
De verschillen zijn echter zo klein dat voor een redelijke scheiding vele malen herkristalliseren nodig is. Duizend maal is daarbij geen uitzondering. Om bijvoorbeeld een geringe hoeveelheid zuiver thuliumbromaat te verkrijgen werd zelfs tot vijftienduizend keer geherkristalliseerd.

Tegenwoordig
Na 1950 maakten moderne scheidingsmethoden het makkelijker de zouten van de zeldzame aarden in redelijke hoeveelheden te scheiden. Continue vloeistofextractie bijvoorbeeld, waarbij de waterige oplossing van de zouten wordt geëxtraheerd met tri-n-butylfosfaat. Een andere methode is ionenwisseling, die zouten met een hoge zuiverheid oplevert en doorgaans op wat kleinere schaal wordt toegepast
De nieuwe scheidingstechnieken dienden in de eerste plaats voor de productie van goede splijtstof voor kernreactoren. Daarbij is het van belang uraan- en thoriumertsen te ontdoen van alle sterk neutronen remmende elementen, zoals de lanthaniden. Dit stimuleerde vervolgens ook het zoeken naar toepassingen en daarmee kwam ook een bredere zoektocht naar zeldzame aarden op gang.
Winning uit erts
Om de lanthaniden te verkrijgen behandelt men het erts, bijvoorbeeld monaziet, met geconcentreerd zwavelzuur bij 200 °C. Daarbij ontstaat een oplossing van de sulfaten van lanthaan, thorium en de aanwezige lanthaniden. Na toevoegen van ammonia slaat eerst het thoriumzout neer. Na toevoegen van natriumsulfaat slaan vervolgens de zouten van de lichtere lanthaniden neer. Na scheiding van de diverse zouten volgt zuivering.
De bereiding van de elementen in zuivere vorm verloopt meestal via elektrolyse van gesmolten zouten. Een andere mogelijkheid is de reductie van oxiden met lanthaan of calcium, of van fluoriden en chloriden met calcium, kalium of natrium. Daarbij wordt het zout gesmolten in een tantalen kroes, gevolgd door reductie (in vacuüm of in een argonatmosfeer) met bijvoorbeeld calciumdamp.
Gadolinium wordt op deze wijze verkregen door reductie van het fluoride met calcium.
Gadolinium wordt ook bereid door het, na allerlei bewerkingen van de mineralen, met natriumsulfaat neer te slaan als het dubbelsulfaat. Na zuivering wordt dit omgezet in gadoliniumchloride (GdCl3). Deze verbinding wordt met kalium- en natriumchloride als eutectisch vloeimiddel bij 765 °C met magnesium gereduceerd in een stikstofatmosfeer.