Aluminium is een zilverwit metaal. Het is licht, niet giftig, niet magnetisch en gemakkelijk te verwerken en bewerken. In zuivere vorm is het zacht en niet sterk. Maar in legeringen met kleine hoeveelheden koper, magnesium, silicium, mangaan of andere metalen is het geschikt voor allerlei toepassingen. Aluminium is het meest voorkomende metaal op aarde maar komt in zuivere vorm niet voor. Het kost veel energie om het uit erts (bauxiet) te isoleren. Het was lange tijd duurder dan goud, totdat er in de negentiende eeuw technologie werd ontwikkeld voor grootschalige aluminiumproductie. Naar verluidt liet Napoleon III tijdens staatsbanketten het eten serveren op aluminium borden.
Symbool
Al
Protonen/elektronen
Groep
Isotopen
27Al
Periode
3
Elektronenconfiguratie
[Ne] 3s2 3p1
Blok
p
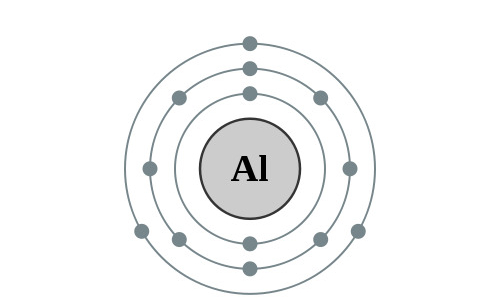
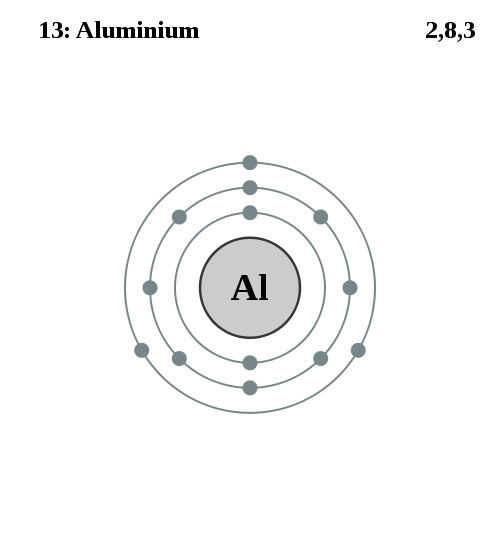
Elektronencofiguratie Bohr
2,8,3
Bij kamertemperatuur
vast
Elektronegativiteit
1,5 (Pauling)
Dichtheid
2700 kg m-3
Atoomstraal
143 . 10-12 m
Smeltpunt
660 oC (933 K)
Relatieve atoommassa
26.9815
Kookpunt
2519 oC (2792 K)
Soortelijke warmte
880 J kg-1K-1
Warmtegeleidingscoëfficiënt
237 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Raam, deur, kozijn
Het lichte en tegelijkertijd sterke aluminium is zeer geschikt als constructiemateriaal. Het is ook nog eens behoorlijk bestand tegen atmosferische invloeden. Aan het oppervlak van zuiver aluminium ontstaat een dun laagje aluminiumoxide, dat het materiaal tegen verdere oxidatie beschermt. Met anodiseren is aluminium nog beter te beschermen en te verfraaien.

Je vindt aluminium vaak in ramen, deuren en kozijnen, vooral bij ‘high tech’ kantoorgebouwen. Ook in grote constructies is aluminium te vinden, zoals bijvoorbeeld bij olieplatforms en bruggen. Ook het schuifdak van de Amsterdam Arena is van aluminium.
Licht en sterk is ook een ideale combinatie voor vervoerstoepassingen:
Auto
Aluminium is in allerlei auto-onderdelen te vinden. Onder de motorkap bijvoorbeeld: in het motorblok, de cilinderkoppen, het carter en de zuigers. Behalve het lage gewicht en de hoge sterkte is hier ook van belang dat aluminium een goede warmtegeleiding heeft en zich goed laat verwerken, met name via (spuit)gieten. Bekend zijn verder de lichtmetalen wielen uit aluminiumlegeringen. Maar ook de carrosserie bevat steeds vaker aluminium. De gemiddelde personenauto bevat zo’n 150 kg van het lichtmetaal en het aandeel groeit nog steeds. De gewichtsbesparing ten opzichte van staal leidt tot een beter acceleratie- en remvermogen, terwijl het brandstofgebruik afneemt.

Metro, tram, trein
Rijtuigen voor metro, tram en trein bevatten aluminium, onder andere in profielen, carrosserieonderdelen en zelfs in veeleisende toepassingen zoals bijvoorbeeld wielstellen. Een bijzondere toepassing zijn aluminium sandwichpanelen zoals Hylite, ontwikkeld bij de Hoogovens in IJmuiden (nu Tata Steel Europe). Het is opgebouwd uit twee lagen aluminium met daartussen een laag kunststof (polypropeen). Ze zijn ongeveer half zo zwaar als stalen panelen.
Schepen
De bouw van grote, snelle veerboten is mogelijk dankzij speciale constructietechnieken met aluminium. Maar ook in (wedstrijd)jachten, reddings-, politie- en loodsboten vind je aluminium.

Vliegtuig
Voor vliegtuigonderdelen is men voortdurend op zoek naar materiaal met een optimale combinatie van gewicht, sterkte, corrosieweerstand en hittebestendigheid. Dit heeft geleid tot veelvuldige toepassing van aluminium in allerlei legeringen. Zo vind je het in vliegtuigvleugels in combinatie met magnesium en zink. Deze materialen zijn 20% lichter dan puur aluminium en goed bestand tegen corrosie. Romp, landingsgestel en trap bevatten vergelijkbare legeringen.
De laatste jaren is licht en brandwerend plaatmateriaal in opmars, opgebouwd uit elkaar afwisselende lagen van aluminium en van vezels geïmpregneerd met kunsthars. De enorme dubbeldeks Airbus A380 met een capaciteit tot 853 passagiers bevat het aan de TU Delft ontwikkelde Glare (GLAss REinforced aluminum), een sandwichmateriaal van aluminium en glasvezel.
In militaire toestellen vind je ook legeringen van aluminium met lithium, die een nog betere verhouding tussen sterkte en gewicht hebben.
Drankblikje, tube, folie
Aluminium is een geschikt verpakkings- en beschermingsmateriaal omdat het niet adsorberend is, niet giftig, corrosie bestendig en luchtdicht. Je vindt het in blikjes en tubes en ook als folie (bijvoorbeeld voor gebruik in de keuken of als wikkel voor chocolade). Omdat aluminium zich goed laat walsen kan het folie zeer dun zijn, tot slechts 6 micrometer (duizendste millimeter) dik. Aluminiumfolie wordt ook toegepast in isoleerdekens, bijvoorbeeld voor te vroeg geboren baby’s, slachtoffers van ongevallen en sporters.

Vooral in de Verenigde Staten worden drankblikjes uit aluminium gemaakt (gelegeerd met enkele procenten magnesium). In Nederland worden nog veel stalen blikjes gebruikt, al wint aluminium terrein (ongeveer een tiende van het totaal).
Kabel
Het vermogen van aluminium om elektriciteit te geleiden is heel behoorlijk. Het is ongeveer 61% van dat van koper. Vanwege het geringe gewicht en de hoge corrosiebestendigheid heeft het de voorkeur voor bovengrondse hoogspanningsleidingen. Meestal wordt een legering gebruikt met zo’n 98 % aluminium en geringe hoeveelheden koper, magnesium, chroom en silicium.
CD
Het reflecterende laagje op een CD bestaat uit aluminium.

Vuurwerk
Zowel siervuurwerk als knal- en flitsvuurwerk bevatten poedervormig aluminium, dat bij ontbranden een helder wit licht geeft. Voor zogenoemde sproei- en waterval effecten gebruikt men ‘aluminiumgries’ met een deeltjesgrootte van maximaal 40 micrometer (duizendste millimeter). Ook mengsels van aluminium en magnesium (50/50) zijn geschikt.
Waterzuivering
Aluminiumsulfaat (Al2(SO4)3, foto) helpt zwembad- en rioolwater te zuiveren. Het dient als vlokmiddel om zogenaamd colloïdaal vuil te verwijderen. Dat zijn microscopisch kleine deeltjes (bijvoorbeeld resten van algen, bacteriën en huidschilfers), die niet via de filters uit het water zijn te halen.

Bij het toevoegen van het aluminiumsulfaat aan het afvalwater treden verschillende reacties op:
.
.
.
De zo gevormde vaste aluminiumhydroxiden destabiliseren het colloïdale vuile water. Het resultaat zijn grote vlokken, die wél zijn weg te filteren. Doorgaans is één gram aluminiumsulfaat per kubieke meter water voldoende.
Supersterk aluminium
Vloeibaar aluminium dat in een fractie van een seconde afkoelt heeft andere eigenschappen dan gewoon aluminium. Door een bijzondere materiaalstructuur heeft het een sterkte die vergelijkbaar is met titanium. Dit proces was lange tijd alleen op laboratoriumschaal mogelijk, maar is nu ook op industriële schaal toepasbaar. Het supersterke aluminium wordt toegepast voor schaatsen, fietsen, automotoren, golfclubs en materiaal voor bergbeklimmers.
Meer toepassingen
Als element en in legeringen
Je vindt aluminium in uiteenlopende toepassingen als
- Biervaten
- Computerschijven
- Fietsframes
- Raketbrandstof
- Rolluiken
- Spiegels en reflectoren
- Verf (metallic)
Legeringen van aluminium met andere metalen hebben eigenschappen (sterkte, corrosiebestendigheid, enz.) die vrijwel ‘op maat gesneden’ zijn voor het gewenste gebruik. De legeringen worden aangeduid met nummers:
| Groep | Gelegeerd met | Toepassingen, o.a. |
|---|---|---|
| 1000 | - | Folie, beplating |
| 2000 | Koper | Vliegtuigbouw, constructiemateriaal |
| 3000 | Mangaan | Gevelbeplating |
| 5000 | Magnesium | Constructiemateriaal |
| 6000 | Magnesium, silicium | Constructiemateriaal (goed lasbaar) |
| 7000 | Zink | Constructiemateriaal (zware, dragende constructies) |
In verbindingen
| Aftershave | KAl(SO4)2.12H2O |
| Antitranspiratiemiddel in deodorant | Al2(OH)5Cl, AlZr(OH)5Cl, AlCl3 |
| Brandwerend middel | Al(CH3COO)3 |
| Cosmetica | Al(C17H35COO)3, Al(OH)3, Al2(SiO3)3 |
| Drukinkt (toevoeging) | Al(C17H35COO)3 |
| Extractiemiddel (opwerking van splijtstofstaven van kernreactoren) | Al(NO3)3 |
| Fixeren van textielverf | Al(HCOO)3 |
| Geneesmiddel | |
| - Bloedstelpend middel | KAl(SO4)2.12H2O |
| - Gorgeldrank, keeltablet, voetpoeder | KAl(SO4)2.12H2O |
| - Neutraliseren van maagzuur | Al2O3 |
| - Zalf tegen jeuk | Al(OH)(CH3COO)2/Al(OH)2(CH3COO) |
| Insecticide | Na3AlF6 |
| Kleuren van textiel | Al(CH3COO)3, Al(OH)3 |
| Leerlooien | Al(NO3)3 |
| Melkglasbereiding | Na3AlF6 |
| Papierlijm | KAl(SO4)2.12H2O |
| Rattengif | AlP |
| Schuurpoeder | Al2O3 |
| Slijpsteen | Bauxiet |
| Tandpasta | Al(OH)3, Al2O3 |
| Vlamvertrager | Al(OH)3 |
| Waterafstotend maken van textiel | Al(HCOO)3, Al2(SO4)3 |
| Waterdicht maken van textiel | KAl(SO4)2.12H2O |
Naam & ontdekking
Naam
De oude Egyptenaren, Grieken en Romeinen gebruikten het aluminiumhoudende aluinsteen als bloedstelpend middel. Het heeft een enigszins bittere smaak en het Latijnse woord voor bitter is alumen. Sinds 1807 werd het metaal uit de aluinsteen daarom op voorstel van de Britse chemicus Humphry Davy aluminum genoemd. De IUPAC, het internationale overlegorgaan van chemici en natuurkundigen, veranderde dat in 1925 in aluminium. Dat was meer in overeenstemming met de namen van andere elementen, die doorgaans op -ium eindigen. In de Verenigde Staten wordt echter nog steeds over aluminum gesproken.

Bauxiet, het belangrijkste aluminiumhoudende erts (foto), is vernoemd naar het plaatsje Les Baux in Zuid-Frankrijk. De Franse mineraloog en geoloog Pierre Berthier ontdekte het erts hier in 1821 als eerste.
Ontdekking
Het is lastig één wetenschapper de ontdekking van aluminium toe te kennen. Drie namen doen de ronde. Allereerst stelde Humphry Davy al in 1807 dat aluin een nieuw metallisch element bevatte. De Deense natuur- en scheikundige Hans Christian Oersted (foto) zou in 1825 als eerste aluminium hebben geïsoleerd, via de reductie van watervrij aluminiumchloride met kaliumamalgaam. Maar ook de Duitse chemicus Friedrich Wöhler wordt genoemd. Hij stelde in 1927 dat Oersted iets anders had gemaakt, mogelijk kalium. Wöhler slaagde er (ook) in aluminium in handen te krijgen, via een vergelijkbare reactie.

Voorkomen
Voorkomen
Aluminium komt op aarde heel veel voor. Met een aandeel van 8,23% staat het op plaats drie in de lijst van meest in de aardkorst voorkomende elementen. Achter zuurstof en silicium.

De belangrijkste mineralen zijn:
| Albiet (foto) | NaAlSi3O8 |
| Aluminiet | Al2(SO4)(OH)4.7H2O |
| Aluniet of aluinsteen | K2SO4.Al2(SO4)3.4Al(OH)3 |
| Alunogeen | Al2(SO4)3.17H2O |
| Bauxiet | AlOx(OH)3-2x, 0<x<1< li=""></x<1<> |
| Beryl | Be3Al2Si6O18 |
| Chioliet | Na5Al3F14 |
| Corundum | Al2O3 |
| Diaspoor | AlO(OH) |
| Gibbsiet | Al(OH)3 |
| Kaoliniet of porseleinaarde | Al2Si2O5(OH)4 |
| Kryoliet of ijssteen | Na3AlF6 |
| Mica | {Na,K,Ca,Mg}{Al,Mg,Fe,Li}2-3{Si,Al}4O10{OH,F}2 |
| Orthoklaas | KAlSi3O8 |
| Petaliet | LiAlSi4O10 |
| Spinel | MgAl2O4 |
| Topaas | Al2SiO4(F,OH)2 |
| Turkoois | CuAl6(PO4)4(OH)8.4H2O |
| Zeoliet | Geen vaste formule; verhouding (Al+Si):O = 1 : 2 |
Winning
De belangrijkste wingebieden voor bauxiet, de grondstof van aluminium, liggen in Guinee, Australië, Brazilië, Rusland, Jamaica, Mali, Guyana, Kameroen, Griekenland, Ghana, Indonesië, Suriname, Tadzjikistan, India, de Verenigde Staten van Amerika, Dominicaanse Republiek, Sierra Leone, Slovenië, Montenegro, Bosnië-Herzegovina, Hongarije, Frankrijk en vele Afrikaanse landen.
De EU heeft met de Critical Raw Materials Act in 2022 het element aluminium en mineraal bauxiet op de lijst van schaarse en strategische grondstoffen gezet.

Bereiding
Bereiding
Vroeger
Een reactie die – tamelijk onzuiver – aluminium oplevert is de reductie van watervrij aluminiumchloride met kaliumamalgaam. De Deense natuur- en scheikundige Hans Christian Oersted maakte daar in 1825 als eerste melding van. In 1854 was de Franse scheikundige Henri -tienne Sainte-Claire Deville de eerste die aluminium in redelijk zuivere vorm isoleerde door elektrolyse van natriumaluminiumchloride (NaAlCl4).
Het zuivere metaal was in die tijd zo zeldzaam dat het samen met de kroonjuwelen werd geëxposeerd. Keizer Napoleon III gebruikte bij officiële staatsbezoeken aluminium borden en bestek.
Nadat in 1871 de dynamo was uitgevonden (door de Belgisch Franse technicus Zénobe Théophile Gramme) werd het mogelijk om grootschalige elektrolyse-experimenten uit te voeren. In 1886 ontwikkelden zowel de Fransman Paul Louis Toussaint Héroult als de Amerikaan Charles Martin Hall een proces voor de elektrolyse van aluminiumoxide opgelost in gesmolten kryoliet (Na3AlF6). Ze wisten op deze wijze zuiver aluminium in relatief grotere hoeveelheden te verkrijgen.

Tegenwoordig
Vandaag de dag begint de productie van aluminium met het oplossen van bauxiet (Al2O3) in geconcentreerde natronloog. Bij hoge temperatuur en druk (250 °C, 35.105 Pa) lost het aluminiumoxide op:
Bij afkoeling van de vloeistof slaat aluminiumhydroxide Al(OH)3 neer:
Bij hoge temperatuur (ca. 975 °C) leidt dat tot zuiver aluminiumoxide. Om hier via elektrolyse het aluminium uit vrij te kunnen maken, wordt het eerst opgelost in bijvoorbeeld gesmolten kryoliet (Na3AlF6). De elektrolyse reacties zijn als volgt:
– pool:
+pool:
Dit gebeurt in een elektrolysevat van koolstof in een metalen omhulsel. Het koolstof fungeert als kathode, en de anode is een elektrode van koolstof (grafiet). Het bij de elektrolyse gevormde vloeibare aluminium wordt in ‘broodjes’ gegoten. Deze worden verder verwerkt tot plaat, buis, profiel en dergelijke.
De bereiding van aluminium vereist zeer veel energie: voor één ton aluminium is ongeveer 13.500 kWh elektriciteit nodig. De productie floreert daarom in landen waar zeer goedkope energie voorhanden is, zoals in het Midden-Oosten en het Golfgebied. India is hierbij een belangrijke leverancier van het benodigde bauxiet.
De herverwerking van aluminium kost slechts 5 – 10 % van de energie die nodig is voor nieuw aluminium en neemt daarom een steeds belangrijker plaats in.