Dit zilverwitte metaal, één van de zeldzame aarden, is behoorlijk reactief en oxideert gemakkelijk in lucht. De high-tech toepassing van neodymium heeft de laatste decennia een hoge vlucht genomen, vooral in magneten voor microfoons, luidsprekers en harde schijven. Neodymiummagneten zijn de sterkste permanente magneten die er bestaan. Een Toyota Prius bevat ongeveer een kilo neodymium.
Symbool
Nd
Protonen/elektronen
Groep
Isotopen
142Nd, 143Nd, 144Nd, 145Nd, 146Nd, 148Nd, 150Nd
Periode
6
Elektronenconfiguratie
[Xe] 6s2 4f4
Blok
f
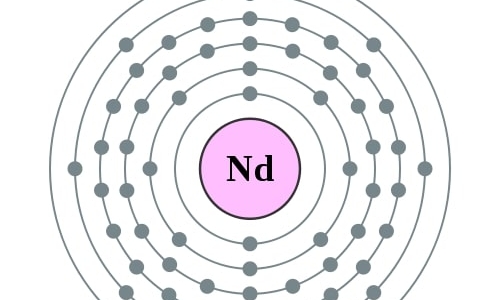
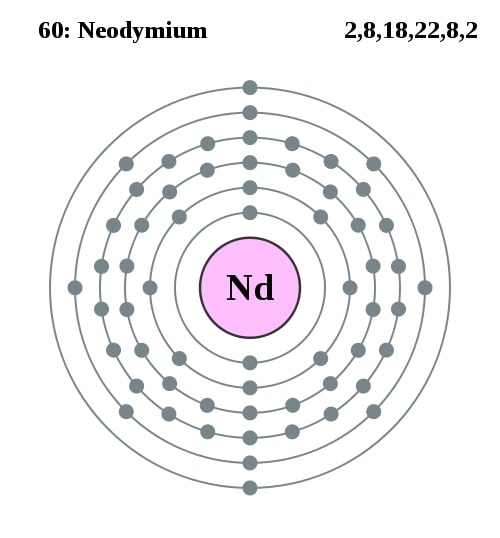
Elektronencofiguratie Bohr
2,8,18,22,8,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,2 (Pauling)
Dichtheid
7010 kg m-3
Atoomstraal
181 10-12m
Smeltpunt
1020 oC (1293 K)
Relatieve atoommassa
144.24
Kookpunt
3027 oC (3300 K)
Soortelijke warmte
190 J kg-1K-1
Warmtegeleidingscoëfficiënt
16,5 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Permanente magneet
Legeringen van zeldzame aarden met metalen als ijzer, kobalt, nikkel en aluminium worden onder andere gebruikt voor permanente magneten. De goede magnetische eigenschappen zijn het gevolg van de aanwezigheid van (meerdere) ongepaarde elektronen.

Neodymiumlegeringen zoals Nd2Fe14B vormen de sterkste permanente magneten die er bestaan. Een magneet van dit materiaal is in staat duizend keer zijn eigen gewicht te tillen. Je vindt deze magneten onder andere in de harde schijf van de computer, in de ‘oortjes’ van mp3-spelers en in speelgoed. En in elektromotoren voor auto-aandrijving, zoals bijvoorbeeld in de Toyota Prius – die bevat bijna een kilo aan neodymium.
Brillenglaskleuring
Neodymiumverbindingen kleuren het glas van brillen of lenzen van violet tot wijnrood. Het wordt vaak toegepast als didymium, een mengsel van praseodymium- en neodymiumoxide. Je vindt dit in het glas van brillen voor lassers en glasblazers omdat het zowel de infrarode als ultraviolette straling wegneemt en de felle gele gloed van de vlam sterk reduceert. Dit glas wordt ook toegepast in lenzen voor astronomische kijkers en in zonnebrillen.

Condensator keramiek
Sommige typen condensatoren hebben een diëlektricum van porselein of keramiek. Dit bevat vaak sporen van de oxiden van lanthaan, neodymium of samarium.
Laser
Neodymium lasers van het type Nd:YAG (YAG: yttrium aluminium garnet) bevatten een lasermedium uit Y3Al5O12-kristal dat ongeveer 1 % neodymium bevat op de plaats van yttrium. De golflengte van deze lasers ligt in het infrarood: 1064 nm. Ze hebben een breed scala aan industriële toepassingen, zoals bijvoorbeeld het snijden, lassen en graveren van metalen. De Nd:YAG laser wordt ook veel gebruikt in de geneeskunde, bijvoorbeeld voor het verwijderen van poliepen op maag en darm of in de blaas, en voor correcties van het hoornvlies. Andere typen neodymium lasers zijn Nd:YLF (yttrium lithium fluoride), Nd:YVO4 (yttrium orthovanadate), en Nd:glass.

Vuursteentjes
De vuur ‘steentjes’ in wegwerpaanstekers en klassieke benzineaanstekers (Zippo’s) zijn gemaakt van mischmetaal. Dat is een legering van zeldzame aardmetalen met pyrofore eigenschappen. Bij het draaien van het aanstekerwieltje komen zeer kleine deeltjes van het mischmetaal los, die spontaan verbranden. Daardoor ontbrandt het gas of de benzinedamp uit het aanstekerreservoir.

De samenstelling van mischmetaal hangt af van de mineralen die bij de productie voorhanden zijn. Bij benadering bevat mischmetaal 45-60% cerium, 15-30% lanthaan, 10-20% neodymium, 4-6% praseodymium, 1-2% samarium en 0,5-1% yttrium.
Meer toepassingen
Als element en in legeringen
- In de metallurgie verbetert neodymium de eigenschappen van magnesiumlegeringen (bij metallische toepassingen is neodymium meestal gemengd met 15 – 25 % praseodymium)
- In de cryochemie; als koeler
In verbindingen
- kleuren van “stenen” voor sieraden (bv. loodglas met sporen Nd-verbindingen)
- pigment voor glas (‘brandschilderen’), email en porselein (roze) Nd2O3
Naam & ontdekking
Naam
De naam is afgeleid van de Griekse woorden neos en didymos, die respectievelijk nieuw en tweeling betekenen. Dat heeft te maken met de ontdekkingsgeschiedenis.

Ontdekking
In 1885 verkreeg de Oostenrijkse wetenschapper Carl Auer von Welsbach (foto) een oxide uit het mineraal samarskiet. Het leek eerst een zuiver oxide te zijn, maar nader onderzoek met gefractioneerde kristallisatie bracht twéé oxides aan het licht. Het oorspronkelijke oxide kreeg de naam didymia en het tweelingkarakter kwam ook tot uitdrukking in de namen van de twee elementen: praseodymium en neodymium.
Zuiver neodymium werd voor het eerst in 1925 bereid via reductie van NdF3 met calcium.
Toelichting: Zeldzame aardmetalen
Neodymium behoort tot de zeldzame aardmetalen. De groep omvat de elementen scandium (21) en yttrium (39) en de elementen 57 tot en met 71. Die laatste reeks is ook bekend als de lanthaniden (naar het eerste element uit de reeks: lanthaan).
Zeldzaam wil niet zeggen dat de betreffende elementen weinig op aarde voorkomen. Het gaat hier om een groep elementen die allemaal ontdekt zijn via de isolatie van hun oxide. De term ‘zeldzaam’ vindt zijn oorsprong in het feit dat deze oxiden (aarden) bijzonder moeilijk te herkennen en scheiden zijn. Het duurde meer dan een eeuw voordat ze allemaal ontdekt waren. In dezelfde periode werd bijna honderd keer de ontdekking van andere nieuwe elementen geclaimd.
Na verloop van tijd kwam de term ‘zeldzaam’ ook in zwang als aanduiding van de elementen zelf. Ze werden vaak pas vele jaren na hun ontdekking in zuivere vorm geïsoleerd.
De nieuwe oxiden vinden hun oorsprong voor het grootste deel in twee mineralen: gadoliniet en ceriet. Daaruit werden respectievelijk de oxidenmengsels yttria en ceria ontsloten.
Het relatief ‘zware’ mineraal gadoliniet was in 1787 door de Zweedse chemicus Carl Axel Arrhenius ontdekt in een wingebied voor veldspaat bij Ytterby (in de buurt van Stockholm). Het heette eerst ytteriet, vandaar dat het verwerkingsproduct in 1794 yttria werd genoemd. Men beschouwde Yttria aanvankelijk als het oxide van één enkel element; het latere yttrium (Y). Uiteindelijk bleek het een mengsel van zowel yttriumoxide als de oxiden van de zwaardere lanthaniden: gadolinium, terbium, erbium, dysprosium, holmium, thulium, ytterbium en lutetium.
Ceria werd in 1803 voor het eerst bereid uit ceriet, dat in 1751 was gevonden door de Zweedse chemicus/mineraloog Axel Fredrik Cronstedt. Het leverde de oxiden op van lanthaan en de lichtere lanthaniden: cerium, praseodymium, neodymium, samarium, europium.
Tot het einde van de 19e eeuw waren er geen toepassingen voor (verbindingen van) de zeldzame aarden. De Oostenrijkse wetenschapper Carl Auer Freiherr von Welsbach bracht daar verandering in. Hij gebruikte thorium en cesium ter verhoging van de lichtopbrengst van een gasvlam. De gaspitten werden daartoe in een mengsel van thorium– en ceriumnitraat gedompeld. Bij de verbranding ontstaan dan de oxiden. Ceriumoxide katalyseert de verbranding en door de zeer slechte geleidbaarheid van het thoriumoxide werden de deeltjes zeer heet en geven ze een helder licht.
Met de vinding van Von Welsbach kwam zowel het grootschaliger speuren naar de zeldzame aarden als het zoeken naar toepassingen in een stroomversnelling. Inmiddels zijn meer dan 100 mineralen bekend met zeldzame aardmetalen. Deze metalen kennen specialistische toepassingen in allerlei hoogtechnologische (elektronische) apparatuur. China is verreweg de belangrijkste producent van deze elementen.
Voorkomen
Voorkomen
De aardkorst bevat 0,00415% neodymium; er zijn 26 elementen die méér voorkomen dan neodoymium.

De belangrijkste mineralen met kleine hoeveelheden van dit element zijn
| allaniet-(Ce) | (Ce, Ca,Y)2(Al,Fe+2, Fe+3)3 (SiO4)3 OH |
| allaniet-(Y) | (Y,Ce,Ca)2(Al,Fe+3)3(SiO4)3 OH |
| bastnaesiet-(Ce) | (Ce,La)CO3F |
| bastnaesiet-(Y) | (Y,La)CO3F |
| fergusoniet-(Ce) | (Ce,La,Nd)NbO4 |
| fergusoniet-(Nd) | (Nd,Ce)NbO4 |
| gadoliniet-(Ce) (foto) | (Ce,La,Nd,Y)2Fe,+2Be2Si2O10 |
| lanthaniet-(Ce) | (Ce,La,Nd)2(CO3)3.8H2O |
| lanthaniet-(Nd) | (Nd,La)2(CO3)3.8H2O |
| monaziet-(Ce) | (Ce,La,Nd,Th)PO4 |
| monaziet-(La) | (La,Ce,Nd)PO4 |
| monaziet-(Nd) | (Nd,La,Ce)PO4 |
Winning
De wingebieden voor neodymium liggen in Australië, China, Mongolië, India, Brazilië, de Verenigde Staten van Amerika, Maleisië, Rusland, Tanzania, Burundi, Zambia, Madagaskar, Noorwegen en Zweden.
Bereiding
Bereiding
Vroeger
Praseodymium behoort tot de lanthaniden en de zeldzame aarden. Deze werden oorspronkelijk gescheiden op grond van de uiterst kleine verschillen in oplosbaarheid van de metaalhydroxiden en -oxiden in loog. Ook bleek het mogelijk te scheiden op basis van de oplosbaarheid van hun zouten, voornamelijk de oxalaten en sulfaten (met name Ln2(SO4)3.Na2SO4.xH2O, met Ln als symbool voor de lantaniden). De oplosbaarheid neemt licht toe naarmate de atoommassa van het lanthanide toeneemt.
De verschillen zijn echter zo klein dat voor een redelijke scheiding vele malen herkristalliseren nodig is. Duizend maal is daarbij geen uitzondering. Om een geringe hoeveelheid zuiver thuliumbromaat te verkrijgen werd zelfs tot vijftienduizend keer geherkristalliseerd.

Tegenwoordig
Na 1950 maakten moderne scheidingsmethoden het makkelijker de zouten van de zeldzame aarden in redelijke hoeveelheden te scheiden. Continue vloeistofextractie bijvoorbeeld, waarbij de waterige oplossing van de zouten wordt geëxtraheerd met tri-n-butylfosfaat. Een andere methode is ionenwisseling, die zouten met een hoge zuiverheid oplevert en doorgaans op wat kleinere schaal wordt toegepast
De nieuwe scheidingstechnieken dienden in de eerste plaats voor de productie van goede splijtstof voor kernreactoren. Daarbij is het van belang uraan- en thoriumertsen te ontdoen van alle sterk neutronen remmende elementen, zoals de lanthaniden. Dit stimuleerde vervolgens ook het zoeken naar toepassingen en daarmee kwam ook een bredere zoektocht naar zeldzame aarden op gang.
Winning uit erts
Het mineraal monaziet bevat (naast 5 – 10 % thoriumoxide, ThO2) enkele procenten van de oxiden uit de zogenaamde yttria-groep (zie tabblad Naam&Ontdekking); andere lanthaniden komen in veel mindere mate voor. Bastnaesiet en allaniet bevatten enkele procenten van – voornamelijk – de oxiden van cerium, lanthaan, neodymium en praseodymium.
Om de lanthaniden te verkrijgen behandelt men het erts, bijvoorbeeld monaziet, met geconcentreerd zwavelzuur bij 200 °C. Daarbij ontstaat een oplossing van de sulfaten van lanthaan, thorium en de aanwezige lanthaniden. Na toevoegen van ammonia slaat eerst het thoriumzout neer. Na toevoegen van natriumsulfaat slaan vervolgens de zouten van de lichtere lanthaniden neer. Na scheiding van de diverse zouten volgt zuivering.
De bereiding van de elementen in zuivere vorm verloopt meestal via elektrolyse van gesmolten zouten. Een andere mogelijkheid is de reductie van oxiden met lanthaan of calcium, of van fluoriden en chloriden met calcium, kalium of natrium. Daarbij wordt het zout gesmolten in een tantalen kroes, gevolgd door reductie (in vacuüm of in een argonatmosfeer) met bijvoorbeeld calciumdamp.