Kalium is een reactief, zilverachtig alkalimetaal. Op lithium na is het ’t lichtste metaal dat we kennen. Het is een essentieel element voor de groei van planten en één van de drie hoofdcomponenten in kunstmest (naast stikstof en fosfor). Ook in het menselijke dieet is het onmisbaar. Kalium is van belang voor het functioneren van zenuwen en de vochtbalans in cellen. Vanwege zijn reactiviteit is kalium in de natuur alleen te vinden in verbindingen met andere elementen. Het oxideert in lucht en kan explosief reageren met water vanwege de vorming van waterstof.
Symbool
K
Protonen/elektronen
Groep
Isotopen
39K, 40K, 41K
Periode
4
Elektronenconfiguratie
[Ar] 4s1
Blok
s
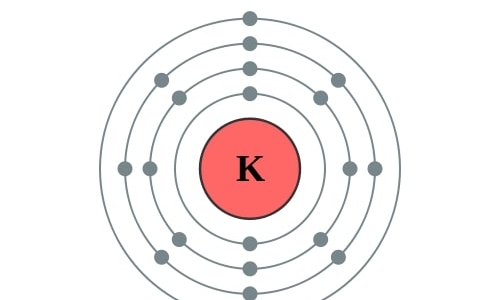
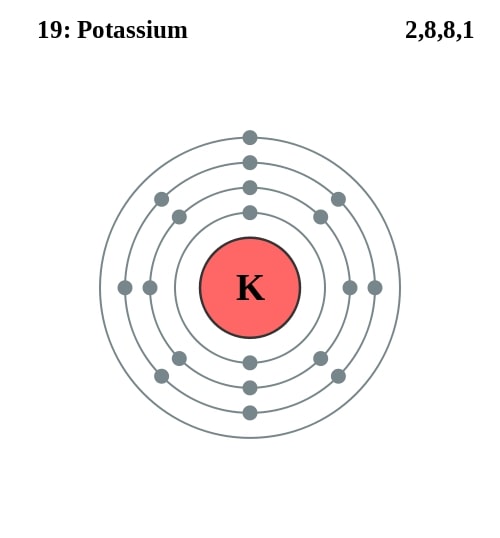
Elektronencofiguratie Bohr
2,8,8,1
Bij kamertemperatuur
vast
Elektronegativiteit
0,9 (Pauling)
Dichtheid
890 kg m-3
Atoomstraal
231 10-12m
Smeltpunt
63 oC (336 K)
Relatieve atoommassa
39.102
Kookpunt
759 oC (1032 K)
Soortelijke warmte
754 J kg-1K-1
Warmtegeleidingscoëfficiënt
130 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Kunstmest
Kalium is een essentieel mineraal voor planten. Je vindt het daarom in diverse soorten kunstmest, bijvoorbeeld als:
- Kaliummonowaterstoffosfaat (K2HPO4)
- Kaliumdiwaterstoffosfaat (KH2PO4)
- Kaliumnitraat (KNO3)
- Kaliumsulfaat (K2SO4)
- Kaliumchloride (KCl)
- Kaliumcarbonaat (K2CO3)
- Kaliumwaterstofcarbonaat (KHCO3)
- Kaliumsilicaat (K2SiO3)

De kaliumzouten worden soms gemengd met andere meststoffen. Met stikstof bijvoorbeeld in kalkammonsalpeter, dat is de combinatie ammoniumnitraat/kaliumchloride. De samenstelling van deze kunstmest is ongeveer 16 % N en 23 % K (op kunstmestverpakkingen wordt het kaliumgehalte altijd uitgedrukt in % K2O). Deze stof is voor vrijwel alle landbouwgronden geschikt, in het bijzonder voor de teelt van rogge en haver.
Glas
Het toevoegen van kaliumverbindingen (zoals oxide, carbonaat, nitraat, sulfaat of silicaat) resulteert in moeilijk smeltbaar glas. Kaliglas en kalikalkglas zijn vanzelfsprekend kalium houdende glassoorten, maar je vindt het ook in Boheems kristalglas (samengesteld uit kalium-, natrium-, calcium– en loodsilicaten) en in Thüringer glas (K2O.CaO.8SiO2). De samenstelling van deze en andere glassoorten varieerde nogal in de loop der eeuwen. De verhouding calcium-natrium-kalium is daarom één van de indicatoren voor de herkomst van antieke glazen.

Lens
Zeer zuiver kaliumchloride (KCl) is bijzonder transparant voor infraroodstralen. In apparatuur voor infraroodspectroscopie zijn daarom vaak vensters te vinden gemaakt uit zogenaamde één kristallen van kaliumchloride. Ook kaliumbromide (KBr) en -jodide (KI) zijn geschikte materialen voor infraroodlenzen en -prisma’s .
Zuurstofmasker
Kaliumsuperoxide (KO2) heeft de opmerkelijke eigenschap dat het CO2 kan binden en tegelijkertijd zuurstof kan vrijmaken. Dat is bijzonder nuttig voor toepassing in gasmaskers voor bijvoorbeeld mijnbouwers en brandweerlieden. Ook in duikboten en ruimtevaartuigen wordt om die reden gebruik gemaakt van KO2. Het reageert als volgt met uitgeademd koolzuur:
of in aanwezigheid van water(damp):

Dieetzout
Kaliumsulfaat (K2SO4) en kaliumchloride (KCl) is te vinden in zogenaamd dieetzout, bedoeld voor mensen die weinig of geen natriumionen mogen innemen. Het kan de smaak van keukenzout (natriunmchloride) vervangen.
Meer toepassingen
Als element
tracer in de geneeskunde (42K)
Als verbinding
| Aftershave | K2SO4 |
| Bakpoeder | kaliumwaterstoftartraat K(OOCCHOHCHOHCOOH) |
| Bloedstelpend middel | KAl(SO4)2.12H2O |
| Conserveringsmiddel voor hout | KHF2 |
| Cosmetica (emulsies) | KH2PO4 |
| Elektrolyt in accu, batterij | KOH |
| Etsen van glas | KHF2 |
| Explosieven | KClO3 |
| Galvaniseerbaden | KCN |
| Geneeskunde( bij kaliumgebrek) | KOOCCH3, kaliumcitraat, KC6H7O7 |
| Goudwinning | KCN |
| Houtbeits | KMnO4 |
| Houtbescherming | KF |
| Insecticide | K2SiF6 , KNCS |
| Kaasbereiding | KNO3 |
| Katalysator bij polymerisatie | KF |
| Keramiek | K2CO3, KNO3 |
| Kleuren van tabak | KNO3 |
| Kleurstof in inkt | K2CrO4 |
| Leerlooien (zeemleer) | KAl(SO4)2.12H2O |
| Tandpasta | KCl of KAc (kalium remt de prikkelgeleiding via de zenuwen) |
| Wijnbereiding | K2S2O5 |
| Zeep | kaliumstearaat, -palmitaat, enz. |
| Zuurteregelaar in voedingsmiddelen, E261 | KOOCCH3 |
Naam & ontdekking
Naam
De naam kalium is afgeleid van al kaly, de Arabische benaming voor de as van planten, die van oudsher een bron is voor kaliumcarbonaat. De Engelse naam potassium heeft in feite dezelfde inhoudelijke oorsprong maar is – opmerkelijk genoeg – afgeleid van het Nederlandse woord potas: de as die na verbranding overblijft in de vuurpot.
Ontdekking
Tot in de achttiende eeuw maakten chemici geen onderscheid tussen natrium en kalium. Ze zagen geen verschil tussen de ‘plantaardige’ alkali (kaliumcarbonaat K2CO3 afkomstig uit verbrandingsas) en ‘minerale’ alkali (natriumcarbonaat Na2CO3 uit afzettingen). In 1702 vermoedde de Duitse chemicus Georg Ernst Stahl een verschil tussen soda (Na2CO3) en potas (K2CO3). In 1736 toonde de Fransman Henri Louis Duhamel du Monceau aan dat er een verschil was tussen de basen kaliloog (KOH) en natronloog (NaOH). Het duurde tot 1807 voordat de Engelsman Humphry Davy (foto) er in slaagde (metallisch) kalium af te scheiden door elektrolyse van gesmolten kaliumhydroxide (KOH). Later dat jaar slaagde hij er op dezelfde manier in om natrium te bereiden uit natriumhydroxide (NaOH).

Voorkomen
Voorkomen
Met een gewichtsaandeel van 2,09% neemt kalium de achtste plaats in op de lijst van meest voorkomende element in de aardkorst. Vanwege de hoge reactiviteit komt het niet voor in de elementaire vorm.

De voornaamste mineralen zijn:
| Carnalliet | KMgCl3.6H2O |
| Kaïniet | MgSO4.KCl.3H2O |
| Langbeiniet | K2Mg2(SO4)3 |
| Lepidoliet | K(Li,Al)3(Si,Al)4O10(F,OH)2 |
| Orthoklaas | KAlSi3O8 |
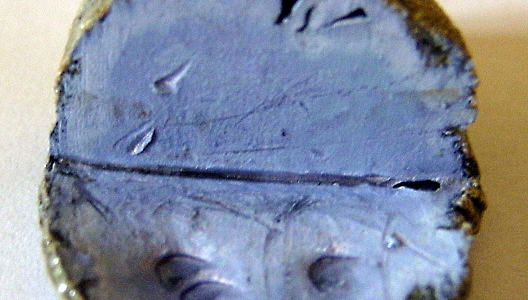
| Sylvien (foto) | KCl |
| Sylviniet | KCl.NaCl |
Ook in de oceanen is kalium het achtste element, met een aandeel van 0,399%. In het menselijk lichaam komt kalium op de zevende plaats met 0,2% van het totale lichaamsgewicht.
Winning
Kalium is meestal in de vorm van kaliumchloride (KCl) te vinden in zeewater en in het water van zoutmeren. De winning van kaliumzouten uit zoutmeren gebeurt onder meer bij het Great Salt Lake (Utah, V.S.) en de Dode Zee (Palestijn). Andere wingebieden liggen in de Verenigde Staten van Amerika, Rusland (voornamelijk in Siberië), Armenië, Oekraïne (De Krim), Wit-Rusland en Canada
Bereiding
Bereiding
Vroeger
Het allereerste elementaire kalium ontstond via elektrolyse van gesmolten kaliumhydroxide (KOH), toegepast door de Engelsman Humphry Davy in 1807. Een jaar later ontwikkelden de Franse chemici Joseph-Louis Gay-Lussac en Louis Jaques Thénard een methode via de reductie van gesmolten kaliumcarbonaat (K2CO3) met ijzervijlsel in een ijzeren pot.

Tegenwoordig
De bereiding van kalium gebeurt op verschillende manieren:
- elektrolyse van gesmolten kaliumhydroxide (KOH) met een kaliumlegering als anode.
- reductie van kaliumcarbonaat met koolstof, bij 1.100 oC:
- reductie van gesmolten kaliumchloride (KCl) met natriumdamp in een stikstofatmosfeer bij 850 oC.
- omzetting van kaliumfluoride met calciumcarbide: