De nucleaire toepassingen en de natuurlijke radioactiviteit hebben uraan (in de volksmond beter bekend als ‘uranium’) tot een iconisch element gemaakt. Dit zwaarst bekende natuurlijk voorkomende metaal is niet bijzonder zeldzaam. Behalve als ‘brandstof’ voor kernreactoren (als verrijkt uraan) kent het ook toepassingen als (contra)gewicht.
Symbool
U
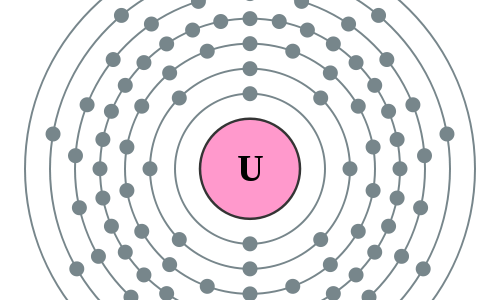
Protonen/elektronen
Groep
Isotopen
234U, 235U, 238U
Periode
7
Elektronenconfiguratie
[Rn] 5f36d17s2
Blok
f
Elektronencofiguratie Bohr
Bij kamertemperatuur
vast
Elektronegativiteit
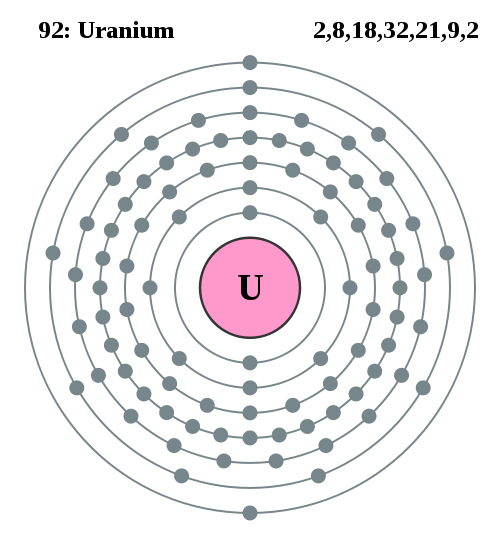
2,8,18,32,21,9,2
Dichtheid
19100 kg m-3
Atoomstraal
138 . 10-12m
Smeltpunt
1135 oC (1408 K)
Relatieve atoommassa
238,029
Kookpunt
4131 oC (4404 K)
Soortelijke warmte
116 J kg-1K-1
Warmtegeleidingscoëfficiënt
21,9 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Kernreactorbrandstof
Uraan (235U) is geschikt als brandstof (splijtstof) voor kernreactoren. Meestal wordt het toegepast in de vorm van het oxide UO2. Dit heeft een grote chemische stabiliteit en een hoog smeltpunt.

De splijtstof wordt verpakt in hulzen van roestvrijstaal, zirkonium of een legering van zirkonium.
Kernsplijting kan optreden als 235U-kernen neutronen invangen, bijvoorbeeld volgens:
Hierbij komt een grote hoeveelheid energie vrij, evenals nieuwe vrije neutronen. Deze kunnen op hun beurt ook weer kernen splijten. Onder de juiste omstandigheden kan zo een kettingreactie ontstaan.
Een voorwaarde is daarbij dat de splijtstof over voldoende splijtbare kernen moet beschikken. Dit is te realiseren door natuurlijk uraan te verrijken (zie tabblad ‘bereiding’) of door andere splijtbare kernen (bijvoorbeeld 233U of 241Pu) toe te voegen.
Een andere voorwaarde is dat de snelheid van de neutronen niet te groot is. In kernreactoren remt men daarom de neutronen af met behulp van een moderator, bijvoorbeeld water of grafiet.
Het vermogen van de reactor is te regelen via de hoeveelheid beschikbare neutronen. Daarvoor wordt gebruik gemaakt van regelstaven van een sterk neutronen absorberend materiaal (zoals cadmium-, hafnium-, gadolinium– of boor verbindingen).
In de splijtstofstaven zelf mogen juist geen neutronen absorberende stoffen aanwezig zijn. Om dit te bereiken zijn speciale scheidingsmethoden voorhanden, zoals ionenwisseling en vloeistof-vloeistof extractie. Daarmee zijn de concentraties cadmium-, hafnium-, gadolinium- of boorverbindingen te verlagen tot onder 0,1 ppm.

Bij gebruik in de reactor stijgt de concentratie van neutronen adsorberende stoffen in de splijtstofstaven. Deze worden daarom regelmatig vervangen. De gebruikte staven gaan naar een opwerkingsfabriek
Bij het splitsen van 235U-kernen komt ongeveer 1 à 2,5 miljoen keer zoveel energie vrij als bij verbranding van vergelijkbare hoeveelheden fossiele brandstof.

De eerste kernreactor (foto) werd op 2 december 1942 onder leiding van de Italiaans-Amerikaanse natuurkundige Enrico Fermi in gebruik genomen op de Universiteit van Chicago. Er werd 6 ton uraan, 50 ton uraanoxide en 400 ton grafiet voor gebruikt. Vanwege het stralingsgevaar heeft de reactor maar korte tijd gewerkt, maar lang genoeg om te bewijzen dat het mogelijk was een kettingreactie te onderhouden en grote hoeveelheden energie vrij te maken.
Ook 233U kan als splijtstof voor kernreactoren dienen; zie hiervoor element 90 – thorium.
Kernkweekmateriaal
Een kweekreactor produceert niet alleen energie maar ook nieuw splijtbaar materiaal. Dit betekent dus een vergroting van de hoeveelheid winbare energie per gram benut uraan. Uiteindelijk kan dit wel een factor honderd vergroot worden.
Uit uraan-238 is volgens onderstaande route plutonium-239 te kweken:
.
.
In een kweekreactor mogen de vrijkomende neutronen niet worden geremd; alleen snelle neutronen produceren voldoende plutonium.
Contragewicht
Uraan heeft een hoge dichtheid. Een kubieke decimeter (een liter) weegt meer dan negentien kilo, dat is bijna twee keer zoveel als lood. Het is (als verarmd uraan – uraan238) veel toegepast als contragewicht in het staartstuk van vliegtuigen. In oudere types van de Boeing 747 werd daarvoor ongeveer 400 kg verarmd uranium verwerkt. De laatste jaren wordt uraan steeds meer vervangen door wolfraam.
Ook in helikopters en raketten vind je verarmd uraan. En in munitie, onder andere in de koppen van anti-pantsergranaten en in kogels. Door de grote dichtheid hebben granaten en kogels met een relatief kleine diameter hetzelfde effect als veel grotere projectielen van ander materiaal.

Gyrokompas
Bij de navigatie van schepen maakt men gebruik van een gyrokompas. Daarin bevindt zich een zeer snel draaiende tol (6.000 – 24.000 omwentelingen per minuut), waarvan de as zich richt naar de aardas. Een tol met een grote traagheid maakt het kompas minder gevoelig voor de bewegingen van het schip. Daarom wordt materiaal gebruikt met een zeer grote dichtheid, zoals verarmd uraan.
Glaskleuring
Uraanverbindingen geven glas een gele of geelgroene fluorescerende kleur. Deze methode van glaskleuring bestond al in de tijd van de Romeinen. In Napels is uraangekleurd glas gevonden uit het jaar 79.
Meer toepassingen
Als element en in legeringen
- atoombom
- bepantsering (legeringen met verarmd uraan)
- beschermend metaal tegen straling, in de luchtvaartindustrie en in ziekenhuizen
- raketonderdelen
- röntgenbuis
In verbindingen
| contrastmiddel bij elektronenmicroscoop | UO2(CH3COO)2 |
| kleurstof voor porselein | UO2 diverse uraanzouten |
| ouderdomsbepaling | (via de verhouding van 233U, 235U en 238U) |
| verven van textiel | UO2(NO3)2 . |
Naam & ontdekking
Naam
De naam uraan is afgeleid van de planeet Uranus, op zijn beurt vernoemd naar de Griekse god Ouranus, die samen met Gaea het oudste godenpaar vormt. De ontdekking van deze planeet in 1781 (door Herschel) had diepe indruk gemaakt in wetenschappelijke kringen. Bovendien was Uranus de verst van de aarde gelegen (bekende) planeet en uraan het element met de grootste atoommassa (en op dat moment het laatste in de lijst van elementen).
In het Nederlands taalgebied is de wat formele benaming uraan zo goed als verdrongen door uranium, dat ook de Engelse benaming voor het element is.

Ontdekking
Uraan werd in 1789 ontdekt door de Duitse scheikundige Martin Heinrich Klaproth (foto) in het mineraal pekblende. Achteraf bleek het om het oxide van uraan te gaan.
In 1841 was de Franse chemicus Eugène-Melchior Péligot de eerste die metallisch uraan verkreeg, door het verhitten van uraantetrachloride met kalium.
Voorkomen
Voorkomen
Voor wat betreft het voorkomen is uraan een heel gemiddeld element. Het staat op nummer 49 in de lijst van meest voorkomende elementen in de aardkorst, met een gewichtsaandeel van 2,7.10-4 %. Uraan is een groot aantal mineralen te vinden. De belangrijkste zijn:
| autuniet of uraanglimmer | CaO(UO2)2(PO4)2.10-12H2O |
| branneriet | (U,Ca,Y,Ce)(Ti,Fe)2O6 |
| carnotiet | K2(UO2)2V2O8.3H2O |
| coffiniet | U(SiO4)1-x(OH)4x |
| curiet | Pb2U5O17.4H2O |
| joliotiet | (UO2)CO3.nH2O |
| kasoliet | Pb(UO2)SiO4.H2O |
| pekblende of uraniniet (foto) | UO2 |
| thoriet | (Th,U)SiO4 |
| tjujamuniet | CaO(UO2)2.V2O8.5-8H2O |
| uranofan | CaO(UO2)2[SiO3(OH)2]2.5H2O |

Winning
De belangrijkste wingebieden voor uraanhoudende ertsen of -mineralen liggen in Canada (Ontario), Zuid-Afrika, Australië, Democratische Republiek Congo, de Verenigde Staten van Amerika (Colorado), Namibië, Niger, Brazilië, Frankrijk, Argentinië en Rusland.
Bereiding
Vroeger
De Franse chemicus Eugène-Melchior Péligot verkreeg in 1841 het eerste metallisch uraan. Hij wist uraanoxide met behulp van chloorgas om te zetten in uraniumtetrachloride, waaruit hij vervolgens via reductie met kalium elementair uraan kon maken.

Tegenwoordig
Vanwege de grote behoefte aan uraan voor nucleaire toepassingen zijn zeer geavanceerde scheidingsmethoden ontwikkeld. Daarmee is het element ook vrij te maken uit ertsen met een zeer laag uraangehalte.
Nadat het erts is voor behandeld gaat de bereiding van start met een procedure voor volledige oxidatie, bijvoorbeeld met mangaan(IV)oxide of geconcentreerd salpeterzuur. Dit leidt ertoe dat alle aanwezige uraan verbindingen zijn omgezet in oplosbare uranylcomplexen.
De uranylionen (UO22+) zijn vervolgens zeer selectief af te scheiden via procedures gebaseerd op ionenwisseling en vloeistofextractie. Indampen leidt vervolgens tot zuivere uranylzouten, die bij 300 °C worden omgezet in uraan(VI)oxide. Bij 700 °C is daar met waterstof zuiver uraan(IV)oxide van te maken.
Door reductie met natrium, kalium, magnesium, calcium, calciumhydride of aluminium verkrijgt men vervolgens het metaal. Het is ook mogelijk uraan(IV)oxide met waterstoffluoride om te zetten in uraatetrafluoride en dat met calcium of magnesium tot het metaal te reduceren. Tenslotte is het metaal te verkrijgen via elektrolyse van het gesmolten oxide, fluoride of chloride.
Verrijken van natuurlijk uraan
Natuurlijk uraan is ongeschikt als splijtstof (‘brandstof’) voor kernreactoren. Het bestaat voor minder dan driekwart procent uit het goed splijtbare 235U. De rest is onbruikbaar 238U.
Met het ‘verrijken’ van uraan wordt het proces aangeduid om het gehalte 235U te verhogen tot ongeveer drie procent, zodat het bruikbaar is in kernreactoren.
Een bekende methode maakt gebruik van het principe van ultracentrifuge. Hiervoor wordt uraanerts eerst omgezet in uraanhexafluoride (UF6). Dit verloopt via het omzetten van uraanoxide tot uraantetrafluoride (met waterstoffluoride), en vervolgens tot uraniumhexafluoride (met fluor):
.
De verbinding met fluor resulteert in een uraangas dat geschikt is voor isotopenscheiding. Fluor is namelijk niet alleen een erg licht element, het komt bovendien slechts voor als één natuurlijke isotoop. Massaverschillen tussen UF6 moleculen berusten daarom uitsluitend op de massaverschillen tussen de uraanisotopen (235 respectievelijk 238 massa-eenheden).

Hiervan wordt gebruik gemaakt in speciale ultracentrifuges. Deze zijn in staat het aandeel van moleculen met 235U te vergroten door met ca. 60.000 – 100.000 omwentelingen per minuut te draaien. Door de centrifugale kracht verplaatsen de zwaardere moleculen (met 238U) zich naar de buitenwand. In het midden van de centrifuge stijgt dus het gehalte van moleculen met 235U. Dit licht verrijkte gas wordt afgezogen en vervolgens opnieuw gecentrifugeerd. Door dit procédé in een cascade van centrifuges (foto) vele malen te herhalen is uiteindelijk uraanhexafluoride met voldoende 235U te verkrijgen.
Uit het verrijkte uraanhexafluoride is weer elementair uranium te maken via reductie met waterstofchloride of jood tot uraniumtetrafluoride, dat vervolgens (bijvoorbeeld met calcium) wordt gereduceerd tot uranium.