Zilver heeft van alle metalen de beste geleidbaarheid voor warmte en elektriciteit en het reflecteert licht het best. Je vindt het dus aan de achterkant van spiegels en in elektrische connectoren. Het is ook een gewild materiaal voor sieraden en siervoorwerpen. De donkere aanslag die na verloop van tijd ontstaat is vooral zilversulfide. Zilver is het enige element waarnaar een land vernoemd is: Argentinië.
Symbool
Ag
Protonen/elektronen
Groep
Isotopen
107Ag, 109Ag
Periode
5
Elektronenconfiguratie
[Kr] 5s2 4d9
Blok
d
Elektronencofiguratie Bohr
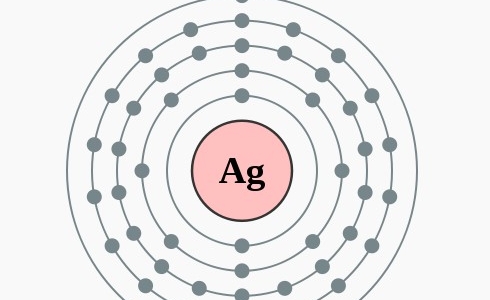
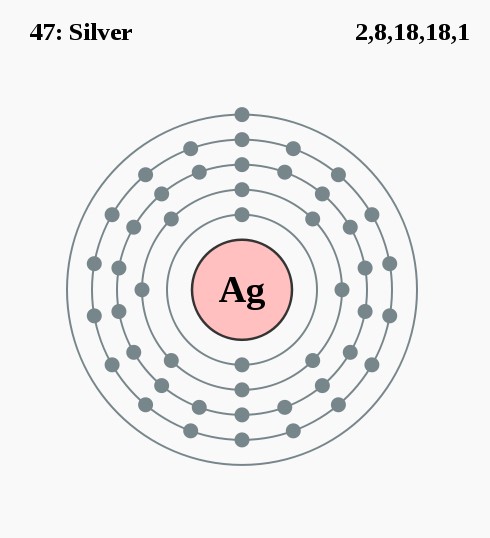
2,8,18,18,1
Bij kamertemperatuur
vast
Elektronegativiteit
1,4 (Pauling)
Dichtheid
10500 kg m-3
Atoomstraal
144 . 10-12 m
Smeltpunt
962 oC (1235 K)
Relatieve atoommassa
107.868
Kookpunt
2162 oC (2435 K)
Soortelijke warmte
240 J kg-1K-1
Warmtegeleidingscoëfficiënt
429 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Spiegel
Zilver is de beste reflector voor licht en is tevens redelijk corrosiebestendig. Goede spiegels bevatten daarom vaak een laagje zuiver zilver aan de achterzijde van een glasplaat. Dit laagje kan op verschillende manieren worden opgebracht: via het neerslaan van zilver uit een zilverzout oplossing; door het toevoegen van een reductie middel of door verwarming; en door opdampen in vacuüm.

Batterij
De bekende knoopcellen voor onder andere horloges, rekenmachines, camera’s en hoortoestellen zijn te koop in verschillende uitvoeringen. Eén daarvan bevat zilver. De spanning wordt dan geleverde via een zink-zilveroxide (Zn-Ag2O) koppel. De reactie bij de stroomlevering door zo’n batterij is:
– pool:
+ pool:
totaal:
Er zijn ook knoopcellen met het koppel AgO/Cd en AgO/Zn en met andere zilveroxiden (Ag2Ox met 1<x<3). Deze cellen kunnen met eenzelfde hoeveelheid zilver meer stroom leveren. Het kenmerk van een zilverbatterij is de relatief hoge energiedichtheid en langdurig stabiele outputvoltage.
Munten, sieraden
Het zilvergehalte van munten en sieraden (en andere zilveren voorwerpen) wordt aangegeven in promille. Een gehalte van 925 – veel gebruikt voor sieraden – wil zeggen dat de legering 92,5 % zilver bevat.
Zilveren sieraden en siervoorwerpen worden gemaakt van zilverlegeringen met relatief veel zilver. Ze worden soms voorzien van een laagje rhodium (gerodineerd) om de glans en krasvastheid te verbeteren. Bij een zilvergehalte lager dan tachtig procent is het wettelijk verboden van ‘zilver’ te spreken (bijvoorbeeld in termen als ‘Duits zilver’ voor een legering als alpaca, die helemaal geen zilver bevat).

Zilveren munten bevatten zo’n veertig tot negentig procent zilver. Meestal is koper toegevoegd vanwege de vereiste hardheid van het materiaal.
Goedkopere ‘zilveren’ sieraden zijn meestal uit minder edel metaal gemaakt en daarna verzilverd.
Antimicrobieel middel
Zilver is aan een opmars bezig in antimicrobiële toepassingen zoals bijvoorbeeld in kleding (sokken en schoenen) en de wanden van koelkasten. Het gaat hier doorgaans om minuscule zilveren nano-deeltjes. Het effect van deze deeltjes is nog niet helemaal duidelijk. Wel is bekend dat zilverionen (Ag+) bioactief zijn en een bacterie- en schimmeldodende werking hebben. Zilverchloride (AgCl) is een bekend antisepticum en colloïdale zilveroplossingen worden voor desinfectie gebruikt.
Medaille, bestek
Zilveren medailles en bestek zijn vaak gemaakt van zilverlegeringen met een zilvergehalte van 80-92,5% (en meestal met koper en/of nikkel). Deze legering is zeer corrosiebestendig.

Meer toepassingen
Als element en in legeringen
- Chemische apparatuur
- Condensator
- Elektrische contacten (Ag, eventueel gelegeerd met Au, Cu of Pd)
- Elektrische smeltveiligheid
- Elektroden
- Folie (tot 2,7 mm)
- Hardsoldeer
- Pigment in suikerwaren en in cosmetica (E174)
- Thermosfles
In verbindingen
| Anti-rookpastilles | AgCH3COO |
| Brandzalf | Zilversulfadiazine |
| Cosmetica, kleuren wenkbrauwen en wimpers | AgNO3 (tot 4 %) |
| Fris houden van bloemen (zeer verdunde oplossing) | AgNO3 |
| Geneesmiddel: | |
| - Verwijdering van wratten en littekenweefsel | AgNO3 |
| - Ontsmettende werking bij neusverkoudheid | Ag-proteïne |
| - Oogdruppels - tegengaan van blindheid bij pasgeborenen | AgNO3 (1 %) |
| - Tegen allergische huidziekten | Ag-sulfadiazine |
| - Behandelen van ontstekingen bij brand- en doorligwonden | Ag-sulfadiazine |
| Knalerwten | Ag3N/Ag2HN |
| Onuitwisbare inkt | AgNO3 |
| Pigment | AgNO3 |
| Verzilveren | AgNO3, AgCN |
Naam & ontdekking
Naam
Het woord zilver is afgeleid van oud-Saksische silubar, dat in het oud-Hoogduits silbar werd en in het nieuw-Hoogduits silber. De betekenis van dit woord is niet bekend. De middeleeuwse alchemisten verbonden zilver vanwege de prachtige glans met de godin van de maan (Luna). Het allereerste symbool voor dit metaal was dan ook een halve maan.

Het symbool voor zilver (Ag) is afkomstig van de benaming argentum uit het Latijn. Dat is net als het Griekse woord argyros van Indo-Europese oorsprong en betekent zoveel als wit blinkend of helder wit.
Ontdekking
Zilver is al bekend sinds ongeveer drieduizend jaar voor Christus, onder meer in Egypte en in het gebied langs de rivier de Eufraat. Het werd daar in metallische (‘gedegen’) toestand aangetroffen. Later werd veel zilver gewonnen in de Spaanse zilvermijnen, in Klein-Azië en Griekenland. Men was destijds ook al in staat het te isoleren uit loodertsen zoals galena (hoofdzakelijk loodsulfide).
De zilver winning in Midden-Europa (onder andere Duitsland, Oostenrijk en Hongarije) stamt uit de vroege Middeleeuwen. Na 1500 is veel zilver ingevoerd vanuit Midden- en Zuid-Amerika. De transporten van zilver en goud uit dit gebied waren een aantrekkelijke prooi voor zeerovers (denk aan de verovering van de zilvervloot door Piet Hein).
Voorkomen
Voorkomen
Zilver is het 68e element op de lijst van meest voorkomende elementen. Het is dus behoorlijk zeldzaam. Het gewichtsaandeel in de aardkorst bedraagt 7,5.10-6%.

Zilver is zowel in ‘gedegen’ toestand (als metaal) aan te treffen, als in verbindingen. De belangrijkste mineralen zijn:
| Argentiet of zilverglans (foto) | Ag2S |
| Broomargyriet of bromiet | AgBr |
| Chloorargyriet of hoornzilver | AgCl |
| Dyscrasiet | Ag3Sb |
| Fischesseriet | Ag3AuSe2 |
| Hessiet | Ag2Te |
| Joodargyriet | AgI |
| Mieargyriet | AgSbS2 |
| Naumanniet | Ag2Se |
| Petziet | Ag3AuTe3 |
| Proustiet | Ag3AsS3 |
| Pyrargyriet of zilverantimoonglans | Ag3SbS3 |
| Stephaniet | Ag5SbS4 |
| Stromeyeriet | AgCuS |
Zilver komt ook (meestal in kleine hoeveelheden) voor in ertsen of mineralen waaruit goud, lood, koper en zink worden gewonnen.
In gedegen toestand wordt zilver gevonden in Duitsland, de Verenigde Staten van Amerika, Italië en Bolivia.
Winning
De belangrijkste wingebieden voor zilverertsen liggen in Mexico, Peru, Rusland (Aziatische deel), de Verenigde Staten van Amerika, Canada (Ontario), Australië, Chili, Japan, China, de Filippijnen en Zuid-Afrika.
Ook in Europa wordt op veel plaatsen zilver gewonnen, onder andere in Polen, Spanje, Zweden, het voormalige Joegoslavië, Griekenland, Roemenië, Duitsland, Tsjechië en Italië (Sardinië). Het belang daarvan neemt sterk af ten voordele van de winning als bijproduct bij de bereiding van lood, koper en zink.
De EU heeft met de Critical Raw Materials Act in 2022 het element zilver op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
Zilver werd meestal bereid uit het zilvererts argentiet. Door smelten en oxideren van het sulfide met behulp van lucht werd het metaal verkregen, meestal gelegeerd met lood of andere metalen. Door omsmelten werd het lood (of andere aanwezige metalen) verwijderd. Reeds vanaf ca. 3000 v. Chr. was men in staat zilver en lood te scheiden.

Tegenwoordig
Een groot deel van de wereldbehoefte aan zilver wordt vervuld via terugwinning uit gebruikt zilver. Dat vindt plaats met verschillende methoden: onder andere elektrolyse; het neerslaan met onedele metalen als ijzer of zink; en ionenwisseling.
Nieuw geproduceerd zilver is vooral een bijproduct van de bereiding van andere metalen, zoals goud, koper, lood, nikkel en zink. Daarvoor wordt het zogenaamde anodeslib verwerkt, het afvalmateriaal van de productie van de genoemde metalen. Men lost het op in warm zwavelzuur, waarbij een niet oplosbaar, zilverhoudende restant achterblijft. Hieruit is zilver te verkrijgen door het te smelten en eventueel aanwezige andere metalen te verwijderen.
Het gevormde ruwe zilver is te zuiveren via elektrolyse volgens het Möbius-procédé. Hierbij wordt het ruwe zilver als anode (in een zak van polypropeen) geplaatst in een aangezuurde zilvernitraatoplossing. Bij de elektrolyse lost de anode op; op de kathode slaat zeer zuiver (> 99,99 %) zilver neer. Dit wordt continu afgeschraapt en verwijderd.
Een wat oudere methode is het oplossen van zilver uit fijngemaakte zilverertsen met behulp van cyanide of kwik (amalgaam).
In het cyanideproces wordt tevens geoxideerd, bijvoorbeeld:
Het zilver wordt uit het cyanidecomplex neergeslagen met zinkstof. Daarna volgt scheiding en zuivering.
Bij het amalgaamproces wordt zilver uit het zilvererts – al dan niet na omzetten in de gewenste vorm – opgelost in kwik, bijvoorbeeld:
.
Het kwik wordt door destillatie verwijderd. Het verkregen zilver kan vervolgens nog verder gezuiverd worden. Dit proces was vroeger vooral gangbaar bij het winnen van zilver uit hoornzilver (AgCl).
Als zilver in lood- of zinkertsen voorkomt, wordt het gewonnen door het erts eerst om te zetten in vloeibaar metaal, zink toe te voegen en vervolgens langzaam af te koelen. De korst van zink en zilver die hierbij ontstaat, wordt verwijderd en het zink wordt afgedestilleerd. Het zilver wordt voor levering in staven gegoten. De zuiverheid bedraagt 99,9 %.