Deze oefentoets bestaat uit drie vragen over het onderwerp groene chemie.
De uitwerking vind je na het openen van alle hints. Let op, sommige vragen hebben geen ‘Controleer antwoord’ knop. Controleer hier zelf je antwoord met behulp van de hints en uitwerking.
Vraag 1
Methylethanoaat (C3H6O2) kun je maken via de volgende reactie:
CH3OH + C2H4O2 🡪 C3H6O2 + H2O
Vraag 2
Volgens een studie van de United Nations Environment Programme worden wereldwijd ieder jaar 325 miljoen loodaccu’s geproduceerd met een gemiddelde massa van 17,2 kg.
De samenstelling van deze accu’s is hieronder weergegeven.
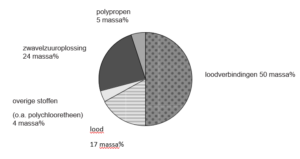
Helaas hebben loodaccu’s een beperkte levensduur. Kapotte accu’s worden op grote schaal gerecycled. Het metaal lood dat uit de accu’s wordt teruggewonnen, is niet alleen afkomstig uit het lood maar ook uit de loodverbindingen. Het terugwinnen van lood uit accu’s levert geld op, want lood is een waardevol metaal.
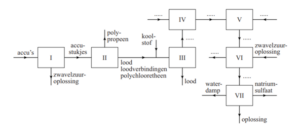
Hieronder is het blokschema weergegeven van het recycleproces.
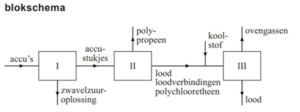
In ruimte I worden de accu’s in kleine stukjes gemalen en wordt de zwavelzuuroplossing verwijderd. Ruimte II is een grote bak met water. Het polypropeen drijft op het water en wordt van het oppervlak afgeschoven. De andere materialen (lood, loodverbindingen en polychlooretheen) zakken naar de bodem. Deze materialen worden naar een oven (ruimte III) overgebracht en daar samen met koolstof verhit tot 1400 °C. In deze oven smelt het lood en treden verschillende reacties op. Bij deze reacties ontstaan zogenoemde ovengassen. Koolstofdioxide, zwaveldioxide en waterstofchloride vormen de hoofdbestanddelen van deze ovengassen. In ruimte III ontstaat ook vloeibaar lood uit de loodverbindingen.
De vergelijking van één van de reacties die optreedt in ruimte III is hieronder weergegeven.
PbO2 (s) + C (s) → Pb (s) + CO2 (g) reactie 1
Zwaveldioxide en waterstofchloride die in ruimte III ontstaan, mogen niet in de lucht worden geloosd.
Zwaveldioxide en waterstofchloride worden uit de ovengassen verwijderd. Het blokschema hieronder is uitgebreid met de ruimtes IV tot en met VII. Met behulp van dat uitgebreide blokschema kan de verwijdering van zwaveldioxide en waterstofchloride uit de ovengassen worden weergegeven. De verwijdering van zwaveldioxide en waterstofchloride verloopt als volgt:
- In ruimte IV worden de ovengassen in contact gebracht met een overmaat natronloog. Hierbij ontstaan opgelost natriumsulfiet, opgelost natriumchloride en opgelost natriumcarbonaat.
- In ruimte V worden de sulfietionen met behulp van zuurstofmoleculen omgezet tot sulfaationen.
- In ruimte VI wordt zoveel zwavelzuuroplossing toegevoegd dat alle hydroxide-ionen worden omgezet tot watermoleculen en alle carbonaationen worden omgezet tot koolstofdioxidemoleculen.
- In ruimte VII wordt de oplossing gedeeltelijk ingedampt. Het natriumsulfaat dat daarbij uitkristalliseert, kan worden gebruikt bij het maken van glas of wasmiddel.
Vraag 3
Tekstfragment:

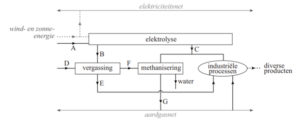
In het tekstfragment zijn drie chemische processen beschreven:
- elektrolyse;
- methanisering;
- vergassing.
Bij het power-to-gas-proces wordt waterstof omgezet tot methaan. Beide gassen kunnen dienen als brandstof. Men kan zich afvragen of de methanisering in de context van duurzaamheid wel zinvol is voor de opslag van energie.
Bij de methanisering (regels 3 tot en met 5) wordt waterstof exotherm omgezet tot methaan volgens:
4 H2 (g) + CO2 (g) → CH4 (g) + 2 H2O (g)
Bij de vergassing (regels 8 tot en met 10) wordt vaste biomassa bij hoge temperatuur omgezet tot voornamelijk synthesegas. Dit kan bijvoorbeeld worden gebruikt voor de productie van vloeibare koolwaterstoffen. Hieronder zijn de processen die zijn beschreven in het tekstfragment, schematisch en vereenvoudigd weergegeven. Dit schema is onvolledig. Bij de stofstromen A t/m G ontbreken de namen.