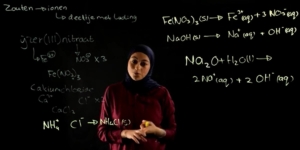Geen zin om het filmpje te bekijken? Lees hieronder de tekst:
Hoi, Ik ben Lotte van de SistersinScience_NL en vandaag ga ik het hebben over redoxreacties zuur-basereacties en hoe je nou het verschil kan zien.
Laten we beginnen bij redoxreacties.
Een redoxreactie is een chemische reactie waarbij er elektronoverdracht plaatsvindt.
Deze reactie vindt plaats tussen een elektrondonor, dat is de reductor, en een elektronacceptor, dat is de oxidator.
Een standaard redoxreactie, hoe ziet hij er nou uit?
Nou, de reductor, de elektrondonor, staat elektronen af. Daarbij ontstaat een reactieproduct en komen er elektronen vrij.
Die oxidator, die neemt elektronen op en daarbij ontstaat ook een reactieproduct.
Eerste reactie, dat is een beetje verwarrend.
De eerste reactie noemen we oxidatie, want de reductor wordt geoxideerd.
Die tweede reactie noemen we reductie, want de oxidator wordt gereduceerd.
Laten we even naar een voorbeeld kijken. Reactie tussen ijzer en koper.
IJzer is een neutrale vorm reageert met het positieve koper ion, Cu2+, tot ijzer ion, F2+ en neutraal koper.
Hier kunnen we zien dat ijzer van zijn neutrale vorm naar het geladen deeltje ijzer2+ gaat.
Hierbij vindt dus elektronen,
IJzer, doneert dus, staat elektronen af.
Dus we kunnen zien dat ijzer hier de reductor is.
Koper gaat van een positieve vorm, 2+ naar de neutrale vorm Cu in de vaste vorm.
Dus we zien dat die elektronen opneemt.
Kunnen jullie dus zien dat ijzer zijn elektronen afstaat aan Koper?
Uiteindelijk is dit dus een redoxreactie, want er vindt overdracht van elektronen plaats.
Oké, begrepen. Laten we gaan kijken naar zuur-basereacties en hoe we nou het verschil kunnen zien.
Zuur-basereactie is een chemische reactie waarbij er protonenoverdracht plaatsvindt.
Hierbij is het zuur. Oh, zeg ik hier zuur. Zuur-basereactie.
Het zuur is hierbij de protondonor, die staat protonen af.
En de base is de protonacceptor, die neemt protonen op.
Een standaardreactie tussen een zuur en base ziet er als volgt uit.
We hebben een zuur, die noem ik even Z met een H-tje.
Ik zeg even dat hij dan positief geladen is.
Die reageert met een base. Dat betekent dat die negatief geladen is.
Daarbij staat het zuur zijn H-tje, H+, af aan de base en houden we dus over zuur zonder H-tje en de base met een H-tje.
Hierbij even naar een voorbeeld kijken, kunnen we kijken naar de reactie tussen het sterke zuur zoutzuur en de sterke basis natronloog.
Als deze twee in oplossing zijn, weten we dat deeltjes die reageren dus zijn H3O+, dat is van het zoutzuur wat opgelost is in water, en OH-. Dat is van de natronloog die is opgelost in water.
Dan weten we dat het zuur zijn H+ afstaat aan de base en houden we dus twee watermoleculen over.
Goed, heel leuk allemaal, Lotte, denk je nu, maar hoe kan ik nou het verschil zien in een reactie?
Laten we even naar een voorbeeld gaan kijken.
Nu moet ik even lang uitschrijven, dus blijf even goed bij me dan ga ik even een ander kleurtje gebruiken.
Laten we kijken naar deze reactie.
Dit is trouwens een voorbeeld vanuit de vraagbaak.
Zo lange reactie, hoe kunnen we hieruit nou zien of het een redoxreactie of een zuur-basereactie is?
We hebben gezien dat bij een redoxreactie er een verschil is in de deeltjes in de lading.
Dus Fe ging van neutraal naar 2+ en koper ging van 2+ naar neutraal.
Bij een zuur-basereactie, gebeurt dit niet.
Hier vindt alleen een overdracht van het proton plaats.
Dus hoe kunnen we nou hier kijken of het een redox of een zuur-basereactie is?
Dan gaan we van alle deeltjes kijken of de lading verandert.
Als we ze nu allemaal gaan uitschrijven, weten we: NH4 is NH4 +, SO4 weten we is SO4 2-. Even spieken, ja twee min. Na is Na+, en OH is OH-.
Als we nou gaan kijken naar de reactieproducten, zijn ze dan op hetzelfde?
Nou, Na kunnen we zien, Na verandert niet, Na+. SO4 verandert hij ook niet, SO4 2-. NH3 is neutraal blijft hetzelfde en we hebben H2O.
Dus hier kunnen we zien dat het enige wat hier plaatsvindt, is het de overdracht van een proton in deze reactie. En is het dus een zuur-basereactie en geen redox.
Nou, denk je, leuk, top! Weet ik hoe dat werkt, en waar heb ik dit nou voor nodig?
Nou, in de scheikunde vinden we het heel erg belangrijk, zijn we heel erg nieuwsgierig, om chemische reacties goed te begrijpen, want hiermee kunnen we nieuwe moleculen ontwerpen en maken. Denk maar eens aan medicijnen. Al die medicijnen moeten door een chemische reactie geproduceerd worden. Dus als we die reacties goed begrijpen, hebben we meer controle over dat proces en kunnen we een nieuwe moleculen maken. En denk bijvoorbeeld eens aan je telefoon, al die materialen die in je telefoon zitten, die het maken. Voor al deze materialen, is een chemische reactie nodig en die willen we heel graag begrijpen.
Ik hoop dat ik jullie hier een beetje mee geholpen heb en ik zie jullie de volgende keer.
Hoi, vond je deze video nou leuk. Wij zijn Lotte, Noor en Mimi van de SistersinScience_NL.
Volg ons op insta en, we zien je bij de volgende video, doei.