Elementair calcium is een grijs, zilverachtig en redelijk hard metaal. Maar het komt als zodanig niet in de natuur voor. In lucht vormt het reactieve metaal spontaan calciumnitride (Ca3N2). Het reageert ook met water en brandt met een geelgroene vlam. Je vindt calcium in allerlei mineralen zoals kalk, gips en vloeispaat (fluoriet). Het behoort tot de aardalkalimetalen en is één van de meest voorkomende elementen in de aardkorst. Calcium is het hoofdbestanddeel van kalk – bekend van de kalkrotsen aan de Engelse kust en van druipsteengrotten. De daar aanwezige stalagmieten en stalactieten zijn van calciumcarbonaat. Die verbinding vormt ook de basis van de cementindustrie. Calcium is een cruciale bouwsteen voor bladeren, botten, tanden en schelpen. In botten en beenderen komt het voor als hydroxyapatiet – net als in tandglazuur.
Symbool
Ca
Protonen/elektronen
Groep
Isotopen
40Ca, 42Ca, 43Ca, 44Ca, 46Ca, 48Ca
Periode
4
Elektronenconfiguratie
[Ar] 4s2
Blok
s
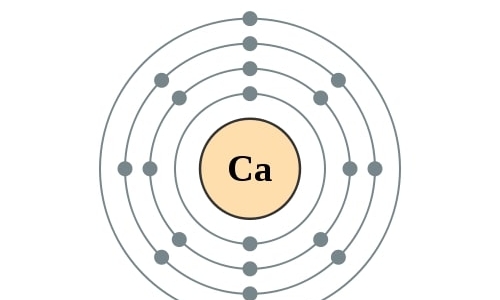
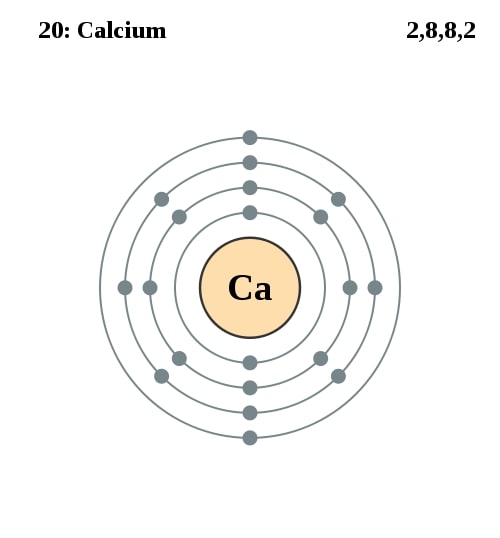
Elektronencofiguratie Bohr
2,8,8,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,0 (Pauling)
Dichtheid
1540 kg m-3
Atoomstraal
197 . 10-12 m
Smeltpunt
842 oC (1115 K)
Relatieve atoommassa
40.08
Kookpunt
1484 oC (1757 K)
Soortelijke warmte
650 J kg-1K-1
Warmtegeleidingscoëfficiënt
96 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Kunstmest
Calcium is een belangrijk mineraal. Bij een tekort kan het gemakkelijk worden aangevuld. Meestal gebeurt dat in combinatie met andere gewenste meststoffen. Als kunstmest worden onder meer de volgende calcium verbindingen gebruikt:
- Kalksalpeter of norgesalpeter Ca(NO3)2
- Superfosfaat, een mengsel van Ca3(PO4)2 en CaSO4

Strooizout
Strooizout ter bestrijding van de gladheid op de wegen bestaat vaak uit calciumchloride. Het is een restproduct van de bereiding van soda (zie element 11 – Natrium)
Krijt
Met ‘natuurlijk’ krijt (calciumcarbonaat, CaCO3) kun je prima op een schoolbord schrijven. Vroeger gebeurde dat ook. Tegenwoordig gebruiken docenten ‘stofvrij’ krijt (anti-dust), gemaakt uit gips (calciumsulfaat, CaSO4).

Gips
Gips vindt toepassing in de bouw, de geneeskunde en in de creatieve sector, onder andere bij het maken van beeldjes en beelden. Het bestaat voornamelijk uit calciumsulfaat, dat relatief veel kristalwater kan bevatten. Dat zijn watermoleculen opgenomen in het kristalrooster van de vaste stof.
Het kristalwater is grotendeels te verwijderen door verhitting tot 130 – 160 °C:
Wanneer aan dit poedervormige gips water wordt toegevoegd ontstaat een gemakkelijk te verwerken en bewerken gladde massa. Denk bijvoorbeeld aan stucwerk en het gipsen van een gebroken been. Deze massa hardt na verloop van tijd uit doordat het aanwezige water weer als kristalwater door het gips wordt opgenomen. Het ‘vloeibare’ water ‘verdwijnt’ daarmee en er blijft alleen vaste stof over.
Bereiding van metalen
Om belangrijke metalen als thorium, zirkonium, uranium en vanadium in zuivere vorm in handen te krijgen gebruikt men calcium als ‘reductiemiddel’. Een voorbeeld:
Calcium is verder in de metallurgie zeer belangrijk voor de bereiding van hoogwaardige producten, aangezien het kan binden met de veel voorkomende verontreinigingen zuurstof en zwavel.
Accu
De elektrodeplaten in de loodaccu bestaan uit een lood-antimoonlegering met 0,1 % calcium. Dit maakt gesloten accucellen mogelijk, waardoor de levensduur omhoog gaat en de onderhoudsbehoefte omlaag.

Cement
Cement is één van de belangrijkste stoffen in de bouwwereld. Het is bekend als ‘lijmmiddel’ bij het metselen van (bak)stenen en wordt gebruikt bij het aanmaken van beton.
De bekendste Nederlands cementfabriek staat in Zuid Limburg. Tot 2018 mag die nog krijtsteen (ook wel aangeduid als ‘mergel’) winnen uit de St. Pietersberg. Het krijt bestaat voornamelijk uit calciumcarbonaat (CaCO3) en dient als grondstof voor het zogenaamde Portlandcement, samen met klei- of leemachtig materiaal (met silicium- en aluminiumoxiden) en ijzeroxide-houdend materiaal. Na mengen, malen en drogen wordt het geheel zeer sterk verhit. Het resultaat is het zogenaamde ‘klinker’ dat voornamelijk uit calciumsilicaat (CaSiO3) en calciumaluminaat Ca3(AlO3)2 bestaat. Dit wordt vervolgens samen met enkele toeslagstoffen zoals gips zeer fijn gemalen tot cementpoeder.

Het poeder dient als bindmiddel in de metselspecie die verder nog zand en water bevat. Het water brengt hydratatiereacties in het cement op gang, waardoor de specie uithardt. Bijzonder is dat deze reactie nauwelijks wordt beïnvloedt door de hoeveelheid water: Portlandcement hardt ook uit bij voortdurende regenval en zelfs onder water.
Vulstof voor papier en verf
Krijt, toegevoegd aan een cellulosebrij, maakt het oppervlak van papier glad. Het zorgt er tevens voor dat het papier wat steviger aanvoelt en helder wit is. Ook gips en calciumsilicaat worden hiervoor gebruikt.
Krijt wordt ook als vulmiddel toegevoegd aan verf (ter verbetering van de helderheid en het dekkend vermogen), inkt, kunststof en mastiek (dakbedekking).
Meer toepassingen
Als element en in legeringen
- Batterij-elektroden
- Gasvanger in hoogvacuümbuis
- Ontzwaveling van aardolie
- Vuursteen (legering met o.a. Ce)
- Zuivering van edelgassen
In verbindingen
| Absorbant voor CO2 | CaO |
| Antiklonteringsmiddel (zout, suiker, enz.) | Ca3(PO4)2, CaSiO3 |
| Bindmiddel in verf | Ca(OH)2 |
| Bleken van textiel | CaSO3, Ca(OCl)2 |
| Blusmiddel | CaCl2 |
| Conserveringsmiddel | |
| - E327 | Calciumlactaat |
| - E333 | Calciumcitraat |
| - E263 | Ca(CH3COO)2 |
| - E282 | Ca(CH3CH2COO)2 |
| - E238 | Ca(HCOO)2 |
| Deegverbeteraar | CaO2, Ca(OCl)2 |
| Droogmiddel | Calciumzepen, o.a. -stearaat |
| Droogmiddel voor gassen | CaCl2, CaO, CaH2 |
| CaF2, Ca3(PO4)2 | |
| Fosforescerende stof | CaS |
| Geneesmiddel | |
| - Tegen kalkgebrek | Ca(CH3CHOHCOO)2, CaCl2, Ca3(PO4)2, calciumascorbaat |
| - Regeling van de bloedspiegel | Calciumgluconaat, {HOH2C-(CHOH)4-COO}2Ca |
| - Stelpen van bloedingen | CaCl2 |
| Glas | CaSiO3, CaCO3, Ca(OH)2 |
| Lichtgevende verf | CaWO4 |
| Ongedierte- en onkruidbestrijder | CaNCN |
| Onkruidbestrijding | Ca(ClO3)2 |
| Ontharingsmiddel | CaO, CaS |
| Papierfabricage, bleekmiddel voor cellulose | Ca(HSO3)2 |
| Tandpasta | Ca(CH3CHOHCOO)2, Ca(HCOO)2, C3H5(OH)2CaPO4 |
| Vochtvreter | CaCl2 |
| Vuurwerk | Ca(ClO3)2 |
Naam & ontdekking
Naam
De naam calcium is afkomstig van de Latijnse naam voor kalksteen: calx. Kalksteen werd al door de Romeinen gebruikt voor het maken van mortel.
Ontdekking
Reeds in de Oudheid kende men calcium in de vorm van kalk en andere calciumverbindingen. De Frans-Schotse natuur- en scheikundige Joseph Black (foto) was de eerste die het element onderscheidde. In 1755 stelde hij het verschil vast tussen calciumoxide en magnesiumoxide, tot dan toe als één en dezelfde stof beschouwd.
De Britse scheikundige Humphrey Davy was in 1808 de eerste die elementair, metallisch calcium isoleerde.

Voorkomen
Voorkomen
Calcium is (na zuurstof, koolstof, waterstof en stikstof) het vijfde element in het menselijk lichaam. We bestaan voor ongeveer 1.4% uit calcium. Het is een essentieel bestanddeel van botten en tanden, in de vorm van hydroxyapatiet.
Ook bij de meest voorkomende elementen in de aardkorst staat calcium op plaats vijf, met een aandeel van 4,15%. Het wordt aangetroffen in diverse vormen van calciumcarbonaat (CaCO3), zoals aragoniet (foto) en calciet (krijt, marmer).

Daarnaast vind je het in een groot aantal andere mineralen, bijvoorbeeld:
| Anhydriet | CaSO4 |
| Colemaniet | Ca2B6O11.5H2O |
| Dolomiet | CaMg(CO3)2 |
| Fluorapatiet | Ca5F(PO4)3 |
| Fluoriet (of vloeispaat) | CaF2 |
| Hydroxylapatiet | Ca5(OH)(PO4)3 |
| Powelliet | CaMoO4 |
| Scheeliet | CaWO4 |
| Tachyhydriet | CaMg2Cl6.12H2O |
| Ulexiet | NaCaB5O6(OH)6.5H2O |
| Zeoliet | geen vaste formule; verhouding (Al+Si):O = 1 : 2 |
Een bijzonder mineraal is albast, een zuiver witte, min of meer doorschijnende gipssoort, die al in de tijd van de Romeinen werd gebruikt voor siervoorwerpen.
Op de zeebodem bevindt zich het calciumhoudende fosforiet {Ca10(PO4)6(OH,F,Cl)2 }. Het aandeel van calcium in zeewater bedraagt een luttele 0,004%, toch staat het daar op plaats zeven van de meest voorkomende elementen.
Winning
De belangrijkste wingebieden liggen in de Verenigde Staten van Amerika, Rusland, Rwanda, Canada, Frankrijk, Italië, China, Mexico, Duitsland, Spanje, Engeland, IJsland, Iran en rondom de Rode Zee. De EU heeft met de Critical Raw Materials Act in 2022 het mineraal gips (anhydriet) op de lijst van schaarse en strategische grondstoffen gezet.

Bereiding
Bereiding
Vroeger
De Britse chemicus Humphrey Davy was in 1808 de eerste die calcium isoleerde. Hij begon met elektrolyse van gesmolten calciumhydroxide met een kwikkathode. Dit leidde tot calciumamalgaam, dat hij vervolgens destilleerde tot – tamelijk onzuiver – calcium. Ook de Zweedse chemici Jöns Jacob Berzelius en Magnus Martin Pontin maakten – onafhankelijk van Davy – calcium via deze methode.

Werkelijk zuiver calcium (foto) werd pas negentig jaar later bereid door de Fransman Henri Moissan, door reductie van calciumjodide (CaI2) met natrium.
Tegenwoordig
Calcium wordt op verschillende manieren verkregen, onder meer door:
- Reductie van het oxide met aluminium bij hoge temperatuur (1100 – 1200 °C) in vacuüm. Calcium ontstaat dan in de vorm van damp die voortdurend wordt afgevoerd:
- Elektrolyse van een gesmolten mengsel van calciumfluoride en -chloride, in een gietijzeren kroes (die als anode dient) en met een ijzeren kathode.
- Reductie van calciumchloride met natrium.