Zirkonium is een hard, zilverachtig metaal. Ongeveer 90 % van de zirkoniumproductie is bestemd voor de kernreactortechnologie. Het metaal absorbeert nauwelijks neutronen en is goed bestand tegen straling en corrosie. Fijne spaanders zirkonium zijn daarentegen tamelijk reactief: ze kunnen spontaan ontbranden. Zirkoonoxide is een prachtige imitatiediamant.
Symbool
Zr
Protonen/elektronen
Groep
Isotopen
90Zr, 91Zr, 92Zr, 94Zr, 96Zr
Periode
5
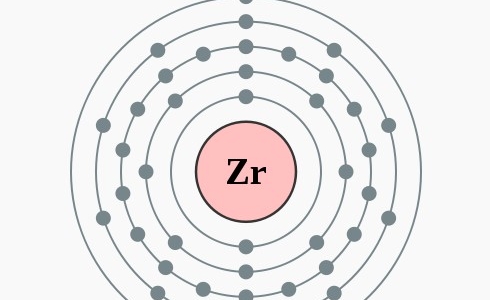
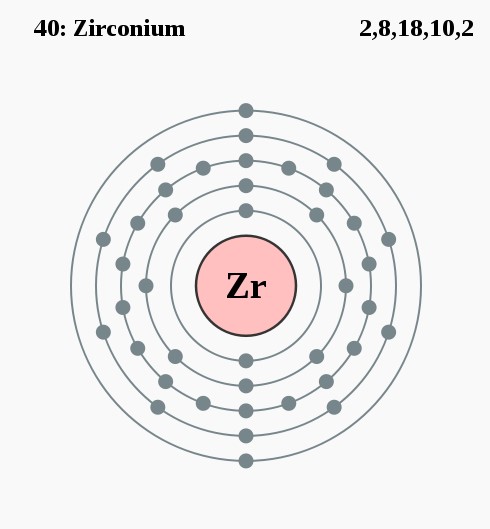
Elektronenconfiguratie
[Kr] 5s2 4d2
Blok
d
Elektronencofiguratie Bohr
2,8,18,10,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,2 (Pauling)
Dichtheid
6510 kg m-3
Atoomstraal
157 . 10-12 m
Smeltpunt
1855 oC (2128 K)
Relatieve atoommassa
91.224
Kookpunt
4409 oC (4682 K)
Soortelijke warmte
278 J kg-1K-1
Warmtegeleidingscoëfficiënt
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Splijtstofomhulsel
Ongeveer 90 % van de zirkoniumproductie is bestemd voor de kernreactortechnologie. Het metaal absorbeert nauwelijks neutronen en is goed bestand tegen straling en corrosie.
In een kernreactor zijn de uraniumoxide splijtstofstaven omhuld door een mantel van Zircalloy, dat is een legering van zirkonium met kleine hoeveelheden tin, ijzer, chroom, niobium en nikkel. Ook de reactor van de eerste nucleaire onderzeeër, de Nautilus, was hiermee uitgerust.

Voor de nucleaire toepassing van zirkonium (en de legeringen daarvan) gelden strenge voorschriften. Boven een temperatuur van 750°C verdwijnt de beschermende oxidelaag op het metaaloppervlak en kan een reactie met water optreden. Daarbij ontstaat het explosieve waterstof. Dit heeft onder meer een rol gespeeld in de ongelukken met kernreactoren in Tsjernobyl (Oekraïne, 1986) en Fukushima (Japan, 2011).
Slaghoedje (munitie)
Slaghoedjes bestaan uit een dun metalen hulsje met daarin een gemakkelijk te detoneren stof. De detonatie van het slaghoedje brengt de rest van de springstof in de munitie tot ontploffing. Om de veiligheid te kunnen garanderen moet het materiaal van de slaghoedjes in hoge mate corrosie bestendig zijn. Zirkoniumlegeringen zijn hiervoor zeer geschikt.
Namaakdiamant
Een goed geslepen kristal zirkoniumoxide (ZrO2, zirkonia) is een uitstekende ‘imitatiediamant’. De kristallen hebben vergelijkbare optische eigenschappen, zijn bijna net zo hard als diamant en worden nauwelijks aangetast. Ze zijn wel honderd tot driehonderd keer goedkoper dan vergelijkbare echte diamanten. Zirkonia is in het laboratorium te fabriceren.

Daarnaast kom je ook het natuurlijke mineraal zirkoon (zirkoniumsilicaat, ZrSiO4) in allerlei sieraden tegen. Afhankelijk van sporen van andere elementen kan de kleur van de steen sterk variëren. In Zweden, Rusland (Oeral) en Australië zijn veel heldere kristallen te vinden die als imitatiediamant kunnen fungeren. In Sri-Lanka vind men roodachtige en gele stenen en in Thailand hemelsblauwe varianten. Verder zijn er diverse geelgroene en diepgroene variëteiten.
Vuurvaste bekleding
De wanden van chemische reactoren en van industriële ovens (bijvoorbeeld voor de bereiding van staal en glas) moeten hittebestendig en inert zijn. Daarvoor worden ze vaak bekleed met zirkoniumoxide (ZrO2) of zirkoniumsilicaat (ZrSiO4), eventueel gemengd met andere materialen. Dat maakt ze chemisch nauwelijks aantastbaar en bestand tegen zeer hoge temperaturen. Bovendien is het warmte geleidingsvermogen relatief gering.
Zuurstofmeter
Het meten van zuurstofgehaltes gebeurt onder andere met een elektrochemische cel waarin het elektrolyt uit zirkoniumoxide (ZrO2) bestaat, met kleine toevoegingen van zeldzame aarden. Je kunt er bijvoorbeeld het zuurstofgehalte in gesmolten metalen mee meten.

Een bekende toepassing is de l-sonde in personenauto’s. Die meet het zuurstofgehalte in het uitlaatgas zodat het motor management systeem in staat is de optimale lucht/brandstof verhouding te regelen. Dit is vooral van belang voor de optimale werking van de driewegkatalysator, die de schadelijke componenten in het uitlaatgas omzet in voornamelijk CO2, H2O en N2.
Meer toepassingen
Als element en in legeringen
- Buizen voor het vervoer van chemische stoffen
- Chirurgische instrumenten
- Lichtkogels en -spoormunitie (poeder)
- Ontzwaveling van gietijzer en staal (ferrozirkoon, Zr met Fe en Si)
- Raketmotor
- Reductiemetaal in de gieterij
- Supergeleiding (Zr met Nb of Zr met Zn)
- Waterstofopslag (zeer fijn verdeeld)
In verbindingen
| Antitranspirant | Al4ZrCl4(OH)12, AlZr(OH)5Cl |
| Brandwerend en waterafstotend maken van textiel | Zr(SO4)2 |
| Contrastmiddel bij röntgenstralen | ZrO2 |
| Drager voor katalysatoren | ZrO2 |
| Flitslamp | Zr(NO3)2 |
| Geneeskunde: | |
| – Keramische implantaten (bv heupkoppen) | ZrO2/Al2O3 |
| – Röntgenonderzoek van maag en darm | ZrO2 |
| Leerbewerking | Zr(SO4)2 |
| Pigment voor glazuur en email (ondoorschijnend maken) | ZrO2, Zr(SO4)2 |
| Pigment in kunststof (geel, bijvoorbeeld in kratten) | ZrSiO4 |
| Smeltkroes | ZrO2 (met MgO) |
| Snij-, slijp- en schuurgereedschap | ZrC2 |
| Zandstralen (Zircosil®, zirkoonzand) | ZrSiO4 |
Naam & ontdekking
Naam
De naam zirkonium is afkomstig van zirkoon, het mineraal waarin het ontdekt is. Die naam is afgeleid van het Arabische ‘zarkoen’ en het Perzische ‘zargûn’, dat goudkleurig betekent (zar = goud, gû = kleur). Soms wordt met de naam zirkoon ook wel het element aangeduid, met name in samenstellingen (bijvoorbeeld: zirkoonoxide).

Ontdekking
De Duitse chemicus Martin Heinrich Klaproth (foto) ontdekte het nieuwe element in 1789 in het mineraal jargon (zirkoon) afkomstig van Ceylon (Sri Lanka). Hij isoleerde een nieuwe ‘aarde’ die hij zirkoonaarde noemde: zirkoniumoxide.
Pas in 1824 isoleerde de Zweed Jöns Jacob Berzelius metallisch zirkonium door reductie van kaliumzirkoniumfluoride met kalium. Het was niet erg zuiver.
In 1925 ontwikkelden de Nederlandse chemici Anton Eduard van Arkel en Jan Hendrik de Boer het naar hen genoemde proces dat zeer zuiver zirkonium oplevert (via ontleding van zirkoniumjodide; zie het tabblad bereiding).
Voorkomen
Voorkomen
Zirkonium is het 18e element in de lijst van meest voorkomende elementen in de aardkorst. Het aandeel is 0,0165 % (op basis van gewicht).
Ook op de zon, in meteorieten en sterren is zirkonium aangetoond, evenals in maanstenen.

Het is aanwezig in de mineralen:
| Baddeleyiet of zirkoonaarde | ZrO2 |
| Hyacinth (zirkoon in edelsteenkwaliteit) | ZrSiO4 |
| Zirkeliet | (Ca,Th,Ce)Zr(Ti,Nb)2O7 |
| Zirkiet | mengsel van zirkoon en zirkoonaarde |
| Zirkoon (foto) | ZrSiO4 |
Zirkonium komt ook voor in de meeste titaanhoudende mineralen zoals rutiel, titaniet, ilmeniet.
Winning
De belangrijkste wingebieden voor zirkonium liggen in Australië, Zuid-Afrika, de Verenigde Staten van Amerika (Florida), Oekraïne, Brazilië, Canada, Burma, Rusland, Kazachstan, Noorwegen, India, Sri Lanka, Pakistan, Thailand, Cambodja, Madagascar en Vietnam.
Baddeleyiet is voornamelijk in Brazilië te vinden.
De EU heeft met de Critical Raw Materials Act in 2022 het element zirkonium op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
De Zweed Jöns Jacob Berzelius was in 1924 de eerste die metallisch zirkonium maakte, door reductie van kaliumzirkoniumfluoride met kalium. Het was niet erg zuiver. Zirkonium werd daarna ook wel bereid door reductie van zirkoniumoxide (ZrO2) met calcium, of door reductie van zirkoniumchloride (ZrCl4) met natrium (bij 500 °C in vacuüm).

Tegenwoordig
Nu past men vooral het Kroll-proces toe. Dit begint met het oplossen van zirkonzand (met daarin het mineraal zirkoon (ZrSiO4)) in salpeterzuur (HNO3).
Voor gebruik in kernreactoren moet zirkonium hafniumvrij zijn. Hafnium komt vrijwel altijd in de zirkoniumertsen voor, maar heeft een veel te hoge neutronenabsorptie. Het mag daarom voor ten hoogste 0,01 % in metallisch zirkonium voorkomen. De verwijdering van hafnium gebeurt door vloeistofextractie van de nitraten, sulfaten of thiocyanaten met tri-n-butyl-fosfaat (TBP) of 4-methyl-2-pentanon.
De volgende stap is het in oplossing aanwezige zirkonium neer te slaan in de vorm van organische zirkoniumverbindingen. Deze worden gemengd met grafiet waarna behandeling met chloorgas tot zuiver zirkoniumchloride (ZrCl4) leidt. Dit wordt vervolgens in een argonatmosfeer bij 800 °C met magnesium gereduceerd. Het resultaat is een harde, redelijk zuivere zirkoniumspons. Deze wordt samengeperst en onder vacuüm in een vlamboog gesmolten. Het aldus gevormde zirkonium wordt nog een laatste keer gezuiverd door smelten in een koperen kroes, die met water wordt afgekoeld om ieder contaminatie met gassen uit de atmosfeer te vermijden.
Bijzonder zuiver zirkonium is te maken met het in 1925 ontwikkelde proces van de Nederlandse chemici Anton Eduard van Arkel en Jan Hendrik de Boer. Hierbij wordt onzuiver zirkonium in een vat met zeer lage druk gebracht, waarin zich wat jood bevindt. Bij verhitting tot ongeveer 200 °C reageert het zirkonium tot ZrI4. Dit verdampt en ontleedt in de buurt van een hete gloeidraad met een temperatuur van circa 1.300 °C) in jood en zirkonium. Het gevormde zirkonium slaat neer op de gloeidraad (van wolfraam of zirkonium).