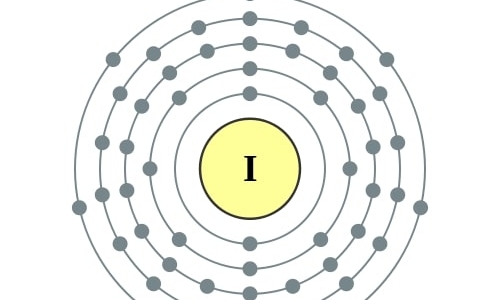
In tegenstelling tot fluor, chloor en broom is jood een tamelijk ‘vriendelijk’ halogeen. Het is een onmisbaar sporenelement dat vooral in de schildklier een belangrijke rol vervult bij de productie van hormonen. De radioactieve isotoop jood-131 wordt gebruikt bij de behandeling van schildklierkanker. Oplossingen van jood in alcohol zijn veelgebruikte ontsmettingsmiddelen. Jood is vast bij kamertemperatuur, maar smelt al bij geringe verhitting en vormt dan vrijwel direct een dichte, violette damp.
Symbool
I
Protonen/elektronen
Groep
Isotopen
127I
Periode
5
Elektronenconfiguratie
[Kr] 5s2 4d10 5p5
Blok
p
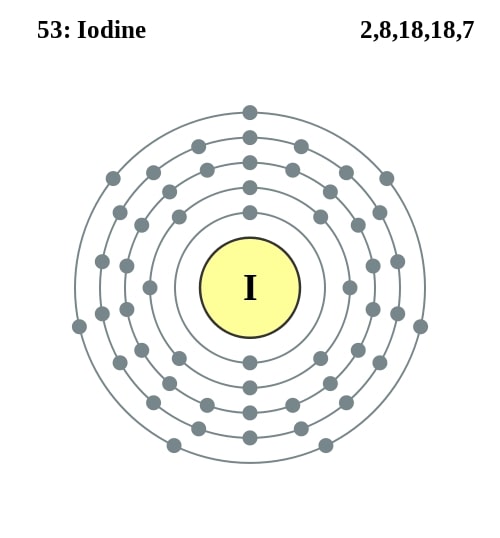
Elektronencofiguratie Bohr
2,8,18,18,7
Bij kamertemperatuur
vast
Elektronegativiteit
2,2 (Pauling)
Dichtheid
4930 kg m-3
Atoomstraal
133 . 10-12 m
Smeltpunt
114 oC (387 K)
Relatieve atoommassa
126.9045
Kookpunt
185 oC (458 K)
Soortelijke warmte
214 J kg-1K-1
Warmtegeleidingscoëfficiënt
0,449 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Jodiumtinctuur
Jodiumtinctuur heeft een desinfecterende werking. De oplossing bevat 2,0% jood, 2,5% natrium– of kaliumjodide en 48,0% alcohol (massapercentages). Omdat jodium bij het gebruik in wonden een bijtende werking heeft, wordt meestal isobetadine als desinfectiemiddel gebruikt. In deze stof zijn de jood moleculen ‘opgeborgen’ in polyvinylpyrrolidon (of povidon). Bij contact met water komt dan een bepaalde hoeveelheid jodium vrij. De door micro-organismen verbruikte jodium wordt weer aangevuld, zodat er een vrij constante hoeveelheid jodium in de oplossing aanwezig is. NASA koos voor dit antisepticum bij de Apollo-, Skylab- en Spaceshuttle-projecten.

Bestraling schildklier
De radioactieve joodisotopen 123I en 131I worden gebruikt bij behandeling en diagnose van aandoeningen in de schildklier (met name kanker). De zwakke gammastraler 123I heeft diagnostische toepassingen (de halfwaardetijd is ongeveer 13 uur). Het isotoop 131I is een wat sterkere gammastraler die zowel gebruikt wordt voor diagnostische als therapeutische toepassingen. Deze heeft een halfwaardetijd van ongeveer 8 dagen. Voor beide isotopen geldt dat ze worden toegediend via verbindingen als tetrajoodtyrosine, zodat ze ingebouwd raken in het groeiregelingshormoon in de schildklier.
Halogeenlamp
Een halogeenlamp is een speciale uitvoering van een gewone gloeilamp. Aan het inerte gas in de lamp is halogeendamp (met name jood) of een halogeenverbinding (bijvoorbeeld methyljodide of methylbromide) toegevoegd. Als gevolg daarvan stijgt de lichtopbrengst (ongeveer het dubbele van een gewone gloeilamp) en de levensduur (ongeveer vijf keer langer).

Het jood in de lamp fungeer als een soort ‘verzorger’ van de gloeidraad. Bij de hoge temperatuur (ca. 3.000 °C) verdampt altijd een kleine beetje van het wolfraam metaal. In het koudere gedeelte van de lamp reageert dat met de jooddamp tot wolfraamjodide (WI4). Dit blijft in dampvorm, en als het in de buurt van de zeer hete gloeidraad komt ontleedt het weer in wolfraam – dat op de spiraal neerslaat – en jood. Dit proces herhaalt zich keer op keer.
Röntgendiagnostiek
Verbindingen van jood met organische moleculen (bijvoorbeeld het natriumzout van tetrajoodfenolftaleïne) dienen als contrastmiddel in de röntgen- en radiodiagnostiek. Het jood in de verbindingen heeft een sterk verstrooiend vermogen voor röntgenstraling. In de diagnostiek wordt ook gebruik gemaakt van verbindingen met een radioactief joodisotoop (125I, 131I of 132I).
Cesiumjodide wordt gebruikt in elektronische detectoren voor röntgenstraling. Hiermee wordt het röntgenbeeld omgezet in digitale informatie, zodat computers de beelden op elk gewenst formaat op een scherm kunnen tonen.
Zout (strumavoorkoming)
Jood is een onmisbaar element voor het menselijk lichaam. De aanbevolen dagelijkse opname bedraagt 0,1 mg jood. De voornaamste bronnen van jood in onze voeding zijn zeevis, schelp- en schaaldieren, eieren, melk, vlees en granen.
Jood is met name aanwezig in de schildklier. Die produceert hormonen die nodig zijn voor een goede werking van het metabolisme van alle cellen. Een tekort aan jodium kan leiden tot aandoeningen van de schildklier zelf, zoals struma (zwelling), maar ook tot andere aandoeningen, zoals een onomkeerbare vertraging van de hersengroei bij jonge kinderen.

Om dit te voorkomen voegt men jood toe aan keukenzout. Dit gebeurt in de vorm van verschillende jood verbindingen, bijvoorbeeld kaliumjodide (Nederland en België) of kaliumjodaat (o.a. in België en Duitsland).
Jodiumtablet tegen radioactieve straling
Radioactieve jood-isotopen zijn bijproducten van de kernsplitsing in kernreactoren. Ze vormen een gevaar voor de gezondheid bij ongelukken met kerncentrales (zoals bijvoorbeeld in Fukishima in maart 2011). Een effectieve manier om de opname van deze isotopen tegen te gaan is het slikken van ‘jodiumtabletten’, Deze bevatten jodide- of jodaatverbindingen die de schildklier met jood verzadigen. De inbouw van radioactief jood in het groeiregelingshormoon wordt dan tegengegaan. Dit beschermend effect is binnen 6 uur na inname aanwezig.
Regenvorming
Door zeer kleine kristallen zilverjodide (AgI) in de atmosfeer te brengen is het mogelijk de vorming van regen te forceren. De kristallen dienen als kiemen waarop de waterdamp condenseert. Als de gevormde druppels groot genoeg zijn vallen ze naar beneden. Deze techniek wordt onder andere toegepast om hagelbuien te voorkomen.
Meer toepassingen
Als element en in legeringen
- Geneesmiddel: bij verkoudheid: een druppel joodtinctuur in een glas water
- Ontsmetting van water
- Zuiveren van metalen (bv. Ti, Zr, Hf)
In verbindingen
| bescherming tegen insecten en schimmels, o.a. in pakhuizen en stallen | Jodofenfos of O-(2,5-dichloor-4-joodfenyl)-O,O-dimethyl-thiofosfaat, |
| fotografie o.a. snelle (lichtgevoelige) film | AgI |
| geneeskunde | |
| - behandeling van arteriosclerose | jodiden |
| - behandeling van reuma | gejodeerde plantenolie |
| - behandeling van schimmelinfecties | KI |
| - behandeling van te sterk werkende schildklier | NaI |
| - hoestdrank | Na- of KI |
| - onderzoek van de nierfunctie | Na123 (en 131)Ihippuraat |
| katalysator bij de bereiding van synthetische rubber | TiI4 |
| laser | CH3I, CF3I |
| ontwikkelaar in de fotografie | NH4I |
| pacemakerbatterij | Ag/RbAg4I5/RbI3, Li/LiI/PbI2 |
| textielkleuring | NaIO3 |
Naam & ontdekking
Naam
De naam jood is afgeleid van het Griekse woord ioeidès, dat violet uiterlijk betekent. De Franse chemicus Joseph-Louis Gay Lussac (foto) gaf de naam in 1813 vanwege de violette kleur van jood (damp en -kristallen).

Ontdekking
Jood is in 1811 ontdekt door de Franse scheikundige Bernard Courtois. Hij ontdekte het in de moederloog (oplosbare fractie) van de as van zeealgen van de kust van Normandië (die tot potas (K2CO3) werden verwerkt). Toen hij een overmaat zwavelzuur toevoegde om de schadelijke zwavel te verwijderen, ontstond jood.
Voorkomen
Voorkomen
Jood staat op plaats 63 in de lijst van meest voorkomende elementen in de aardkorst. Het aandeel bedraag 4,5.10-5 % (op basis van gewicht).
Jood is in de vorm van opgeloste jodiden te vinden in zeewater en in het water dat afkomstig is van zoutmijnen en olieboringen. Het is als natrium- en magnesiumjodide een belangrijk bestanddeel van zeewier.

Ook komt het voor in chilisalpeter (voornamelijk als natriumjodaat), in steenkool en in diverse mineralen, zoals:
- Bruggeniet Ca2(IO3)2.H2O
- Joodargyriet AgI
- Lautariet Ca(IO3)2
- Marshiet (foto) CuI
Lucht bevat, vooral in de kuststreken, tot 10-6 % jood.
Het menselijk lichaam bevat ongeveer 20 milligram jood, vooral in de schildklier.
Winning
De belangrijkste wingebieden liggen in de Verenigde Staten (o.a. Michigan – ondergronds bassin – en Californië), Indonesië (Java), Japan (in bronnen), Rusland, Chili (in chilisalpeter), Duitsland, Noorwegen, het Verenigd Koninkrijk en Frankrijk (uit zeewater en zeewier).
Bereiding
Bereiding
Vroeger
Jood werd bereid door verhitting van een jodide met geconcentreerd zwavelzuur en sublimatie van de ontstane damp:

Tegenwoordig
Jood wordt nu bereid door:
- Reductie van jodaten met sulfiet of zwaveldioxide:
- Inleiden van chloor in een jodide-oplossing: