Het vaalgele element zwavel is een in water onoplosbare vaste stof. Het vervult een belangrijke rol in levende cellen en is onderdeel van twee aminozuren. Mogelijk diende waterstofsulfide (H2S) als energiebron voor het allereerste leven op aarde. Zwavelverbindingen zijn vaak onwelriekend: de geuren van stinkdieren en van knoflook, evenals slechte adem, vinden hun oorsprong in zwavelverbindingen. Langere blootstelling aan waterstofsulfide, bekend van de stank van rotte eieren, vermindert het geurvermogen. In hogere concentraties is het giftig. Curieus is dat zwavelverbindingen ook bij veel prettiger geuren een rol spelen, zoals bij rozen, koffie en tropisch fruit. Zwavelzuur is enorm belangrijk voor allerlei chemische processen, onder andere de productie van kunstmest. Het is ook cruciaal voor de productie van rubber (vulkanisatie).
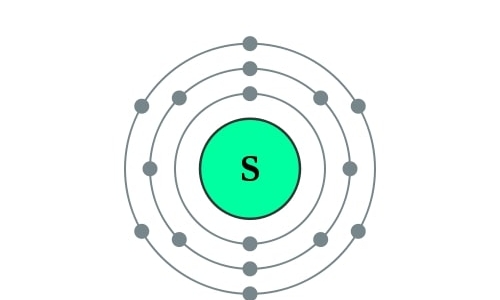
Symbool
S
Protonen/elektronen
Groep
Isotopen
32S, 33S, 34S, 36S
Periode
3
Elektronenconfiguratie
[Ne] 3s2 3p4
Blok
p
Elektronencofiguratie Bohr
2,8,6
Bij kamertemperatuur
vast
Elektronegativiteit
2,4 (Pauling)
Dichtheid
2000 kg m-3 (S8, monoklien)
Atoomstraal
104 . 10-12m
Smeltpunt
115 oC (388 K)
Relatieve atoommassa
32.064
Kookpunt
445 oC (718 K)
Soortelijke warmte
730 J kg-1K-1
Warmtegeleidingscoëfficiënt
0.269 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Buskruit
Zwavel heeft sterk reducerende eigenschappen (het kan gemakkelijk elektronen afstaan) waardoor het – in combinatie met de juiste oxidator – zeer brandbaar of zelfs explosief kan zijn. Dit effect wordt al eeuwenlang benut in buskruit, dat een mengsel is van zwavel, koolstof en kaliumnitraat in de verhouding 2:3:15. Kaliumnitraat is een sterk oxidatiemateriaal, koolstof en zwavel zijn de reductoren.
De (vereenvoudigde) reactievergelijking luidt:
Uit 1 kg buskruit ontstaat ongeveer 1 m3 gas. Als dit gas gevormd wordt in een beperkte ruimte, ontstaat een geweldige drukopbouw. Het effect is bekend: buskruit stuwt kogels en projectielen over grote afstand, waarna deze flinke bressen in muren kunnen slaan.

Vuurwerk
Bij toepassing in vuurwerk heet het explosieve mengsel een sas. De oxidator is ook hier meestal kaliumnitraat (KNO3), maar kaliumchloraat (KClO3) komt ook voor. De vuurwerkmaker stemt de hoeveelheid zwavel af op het gewenste soort sas. Een drijfsas zorgt voor de voorstuwing van vuurpijlen, een knalsas vind je in rotjes en een kleursas is een essentieel onderdeel van siervuurwerk. In een fluitsas, onder meer te vinden in gillende keukenmeiden en luchthuilers, wordt meestal geen zwavel verwerkt
Zwavelzuur, kunstmest
Het overgrote deel van alle geproduceerde zwavel (meer dan 80%) dient voor de bereiding van zwavelzuur (H2SO4), waarbij vanadiumpentaoxide op kiezelzuur als katalysator dient.
In de eerste stap van de reactie wordt het zwavel (of een zwavelhoudende verbinding) verbrand:
Het zo verkregen zwaveldioxide wordt bij 500 °C omgezet in het trioxide:
Dit lost men op in zwavelzuur. Hierbij ontstaat rokend zwavelzuur, dat na mengen met water geconcentreerd zwavelzuur oplevert:
Zwavelzuur is van belang voor allerlei chemische syntheses. Het wordt toegepast bij de productie van kunstmest, de bereiding van kleurstoffen, synthetische vezels, medicijnen, insecticiden, antivries en katalysatoren voor petrochemische industrie. Het speelt ook een rol bij de bereiding van andere zuren zoals salpeterzuur, fosforzuur, waterstofchloride en boorzuur.
Enkele voorbeelden van zwavelhoudende kunstmest zijn:
- Ammoniumsulfaat (NH4)2SO4
- Kaliumsulfaat (K2SO4)
- Superfosfaat, verkregen uit calciumfosfaat en zwavelzuur:

Vulkaniseren rubber
Natuurlijk rubber wordt als sap afgetapt uit verschillende plantensoorten. De bekendste is de Braziliaanse rubberboom (Hevea brasiliensis). Het sap is een natuurlijke latex: een melkwitte emulsie van natuurlijke polymeren in water. Bij het drogen van het sap klonteren de polymeren samen tot een vaste, flexibel substantie.
In 1839 ontdekte de Amerikaanse uitvinder Charles Goodyear dat het verwarmen van natuurlijke rubber met zwavel tot materiaal met veel betere eigenschappen leidt. Dit proces wordt vulkaniseren genoemd.
Het vulkaniseren verbindt de in de latex aanwezige polymeerketens (cis-isopreen) met elkaar via zwavelbruggen. Daarbij ontstaat een ruimtelijk netwerk:
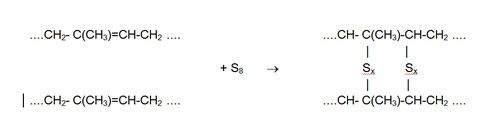
Vulkaniseren maakt het natuurrubber veel sterker een geeft het goede elastische eigenschappen. Het zwavelpercentage ligt doorgaans tussen 1 en 5 %, afhankelijk van de toepassing. Rubber met een hoger zwavelgehalte is hard en nauwelijks flexibel.
Vandaag de dag gebruikt men vooral synthetisch rubber. In de jaren dertig en veertig van de vorige eeuw bleek de hoeveelheid beschikbare natuurlijke rubber al ontoereikend voor de sterk groeiende automobielindustrie. Ook de Tweede Wereldoorlog vergrootte de behoefte aan rubber. De oplossing lag in de productie van synthetisch rubber.
Synthetisch rubber is vaak een copolymeer opgebouwd uit styreen- en butadieenketens (vandaar de naam SBR rubber). Ook nu worden deze via een vulkanisatieproces tot een ruimtelijk elastisch netwerk verbonden:
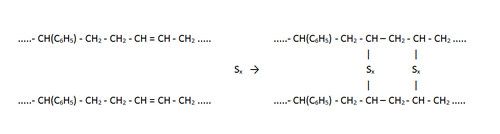
Conserveringsmiddel
Zwaveldioxide en de natrium-, kalium- en calciumzouten van sulfiet en waterstofsulfiet (of disulfiet) zijn geschikte bacteriedodende middelen. Zwaveldioxide wordt onder meer gebruikt voor het conserveren van veevoer in silo’s en voor krenten en rozijnen. Sulfieten zijn te vinden in allerlei levensmiddelen zoals worst en wijn. De aanduiding voor sulfieten op het etiket van voedingswaren is E-220 t/m E-227.
Haarverzorging
Haar is opgebouwd uit ketens van het eiwit keratine. Deze zijn als een spiraal opgerold, waarbij dwarsverbanden van (onder andere) zwavelbruggen voor stevigheid zorgen. Bij het permanenten van haar verbreekt de kapper een deel van deze zwavelbruggen. Nadat het haar met krullers in de gewenste vorm is gebracht worden de dwarsverbanden weer hersteld en voilá: de weelderige haardos is een feit .
De permanentvloeistof die de zwavelbruggen afbreekt bevat een reductor, bijvoorbeeld een basische oplossing met thioglycolzuur (CH2SH-COOH):
.

Ook het wassen met een basische shampoo bevordert het verbreken van de zwavelbruggen.
Het herstel van de zwavelbruggen gebeurt met een fixeervloeistof. Deze bevat een oxidator, bijvoorbeeld waterstofperoxide of kaliumbromaat, die de SH-bindingen weer oxideert tot een zwavelbrug:
De fixeervloeistof bevat ook zuur, waardoor de base van de permanentvloeistof wordt geneutraliseerd. De zwavelbruggen zijn redelijk bestand tegen inwerken van water. Daardoor blijft het kruleffect langere tijd in stand.
Meer toepassingen
Als element en in legeringen
- Cosmetica
– Dermatologische middelen
– Geneeskrachtige baden tegen jicht, psoriasis, eczeem, ontstekingen
– Preparaten tegen acne en roos
In verbindingen
| aardolieraffinage | H2SO4 |
| accuzuur | H2SO4 |
| badzout | MgSO4 |
| bleek- en reinigingsmiddel | KHSO5 |
| bleekmiddel, o.a. voor suikers | Na2S2O4 |
| bleekmiddel voor papier, wol, stro en zijde | SO2 |
| blusmiddel | K2SO4, MgSO4 |
| brandwerend en waterafstotend maken van textiel | Zr(SO4)2 |
| cement | MgSO4 |
| deodorant (toevoeging) | ZnSO4 |
| desinfectiemiddel | FeSO4, MnSO4 |
| fluorescerende (kleur)stof | CuS, BaS, SrS, CuCNS |
| fotocel | Tl2S |
| fris houden van bloemen | NiSO4 |
| halfgeleider | InS6, PbS, Tl2S |
| houtconservering | FeSO4, HSO3Cl |
| inktbereiding | FeSO4.7H2O |
| insecticide | CuSO4 |
| kunstzijde- en cellulosebereiding | CS2 |
| laxeermiddel | MgSO4 |
| leerlooien | Zr(SO42 |
| lichtecht maken van textiel | CuSO4 |
| maagfoto (bariumpap) | BaSO4 |
| meststof | MnSO4, MgSO4 |
| onkruidbestrijding | FeSO4 |
| ontharing van huiden in de leerlooierij | BaS, NaHS |
| ontharingsmiddel | CaS |
| tegen stankoverlast | FeSO4 |
| verven kunstzijde | Cu(CNS)2 |
| wasmiddelen | sulfonzuren |
| waterafstotend maken van textiel | Al2(SO4)3 |
| wijnbereiding | K2S2O5 |
| zeep(toevoeging) | SeS2 |
| zuiveren van olie | H2SO4 |
Naam & ontdekking
Naam
Over de herkomst van de naam zwavel bestaan verschillende theorieën. Zo zouden zwavel en (het Latijnse) sulfur (sulphurium: ‘de steen die brandt’) van hetzelfde woord afstammen, evenals ons woord suf. Dat laatste zou dan weer wijzen op de bedwelmende werking van zwaveldampen. In het Sanskriet is de naam voor zwavel: shulbari (wat ‘vijand van koper’ betekent), in het Oudsaksisch: sweval of swebal.
Ontdekking
Zwavel en koolstof zijn de enige niet-metalen die lang vóór onze jaartelling al bekend waren. Het werd in de Oudheid al als geneesmiddel gebruikt. Homerus vermeldt het gebruik van zwavel als ontsmettingsmiddel; de Romeinen gebruikten het als dermatologisch geneesmiddel.
De Franse chemicus Louis Joseph Gay-Lussac was de eerste die zwavel als element beschouwde.

Voorkomen
Voorkomen
Zwavel vervult een belangrijke rol in levende cellen en is onderdeel van twee aminozuren. Het menselijk lichaam bevat ongeveer 0,2% zwavel, dat is gemiddeld zo’n 120 gram.
Zwavel staat op plaats 16 in de ranglijst van meest voorkomende elementen in de aardkorst. Het heeft een aandeel van 3,5.10-2 % op basis van gewicht. Ook oceanen bevatten veel zwavel. Het gewichtsaandeel is daar 0,1%.
In elementaire vorm vind je zwavel in vulkaanafzettingen (foto) en in zoutkoepels.

Als verbinding vind je het hoofdzakelijk in gipsafzettingen (CaSO4) en in mineralen,
Als sulfaat:
| anglesiet | PbSO4 |
| bariet | BaSO4 |
| chalcanthiet | CuSO4.5H2O |
| epsomiet | MgSO4.7H2O |
| kieseriet | MgSO4.H2O |
| mirabiliet | Na2SO4.10H2O |
Als sulfide:
| argentiet of zilverglans | Ag2S |
| bismutiniet of bismutglans | Bi2S3 |
| chalcosien of koperglans | Cu2S |
| cinnaber | HgS |
| covellien | CuS |
| galena, loodglans of loodspies | PbS |
| milleriet | NiS |
| pyriet | FeS2 |
| sfaleriet of zinkblende | (Zn,Fe)S |
| tungsteniet | WS2 |
Daarnaast is het in de natuur aan te treffen in organische zwavelverbindingen (bijvoorbeeld in aardolie, en in aminozuren) en als zwavelwaterstof (bijvoorbeeld in aardgas en vulkanische gassen).
Winning
De belangrijkste wingebieden van zwavel liggen in Canada (Alberta), Polen, China, Italië (Sicilië), de Verenigde Staten van Amerika (Louisiana en Texas), Mexico, Oekraïne, Rusland, Turkmenistan, Oezbekistan, Afghanistan, Irak, Peru, Bolivia, Japan, de Filippijnen, de Kourillen, Kamchatka, Chili, Duitsland en Frankrijk.
In veel gevallen wordt direct elementair zwavel gewonnen, maar men wint ook zwavel uit zwavelverbindingen verkregen uit vulkaanafzettingen en uit gas (bijvoorbeeld Canada, Duitsland, Frankrijk) of olie (bijvoorbeeld Verenigde Staten, Japan, Nederland).
Het voor de zwavelzuurbereiding belangrijke zwaveldioxide wordt tevens op vrij grote schaal verkregen bij het roosten van zwavelhoudende ertsen.
De EU heeft met de Critical Raw Materials Act in 2022 het element zwavel op de lijst van schaarse en strategische grondstoffen gezet.

Bereiding
Bereiding
Vroeger
Al sinds mensenheugenis graaft men elementair zwavel af. Zonodig werd het gezuiverd door enkele malen om te smelten. Later werd zwavel ook gedestilleerd.
Tegenwoordig
Zwavel wordt op verschillende manieren gewonnen:
Via dagbouw en uit sulfiden en sulfaten. Het aandeel van deze methoden daalt sterk.

Via het Frasch-proces, voor zwavel dat zich in diepere aardlagen bevindt (meestal 20 – 40 % S). Hierbij wordt een schacht geboord met daarin een systeem van drie concentrische pijpen. Eerst wordt oververhit water (165 °C) in de betreffende aardlaag gebracht, waardoor het aanwezige zwavel smelt (smeltpunt 119 °C) en naar het diepste punt bij de pijp vloeit. Via perslucht in een andere pijp wordt het omhoog gebracht. Op deze wijze is zwavel te winnen in een gebied van ongeveer 0,5 ha rond de schacht. De verkregen zwavel is vrij zuiver (99,5 – 99,9 %) en wordt meestal in vloeibare vorm getransporteerd (per pijpleiding, trein of schip).
De ontzwaveling van aardolie in moderne raffinaderijen levert grote hoeveelheden zwavel op. Het wordt eerst omgezet in waterstofsulfide, dat vervolgend wordt gereduceerd:
.