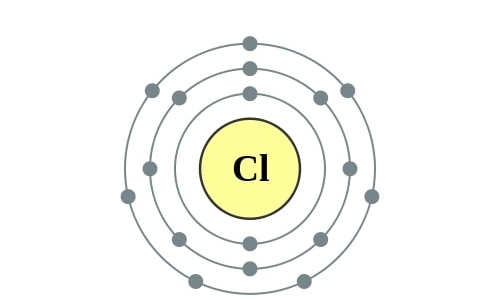
Chloor is een reactief groengeel gas dat met vrijwel alle andere elementen verbindingen aangaat. De bekendste is ongetwijfeld NaCl, te vinden in keukenzout en zeewater. Chloor is ruimschoots aanwezig in oceanen, met een gewichtsaandeel van bijna 2%. Zeeën en oceanen bevatten zo’n 30 tot 40 gram zout per liter. Chloorgas geniet de twijfelachtige eer het allereerste chemische wapen te zijn, gebruikt tijdens de Eerste Wereldoorlog. Gelukkig heeft het element ook z’n goede kanten. Het redde vele levens bij het desinfecteren van water bij de Londense cholera-epidemie in het midden van de negentiende eeuw. Nog steeds is de ontsmetting van (zwem)water een belangrijke toepassing van chloor. Het is ook van belang bij de productie van geneesmiddelen. Polyvinylchloride (PVC) is een veelgebruikte kunststof. De ‘stomerij’ reinigt kleding met een chloorverbinding (het ‘chemisch reinigen’).
Symbool
Cl
Protonen/elektronen
Groep
Isotopen
35Cl, 37Cl
Periode
3
Elektronenconfiguratie
[Ne] 3s2 3p5
Blok
p
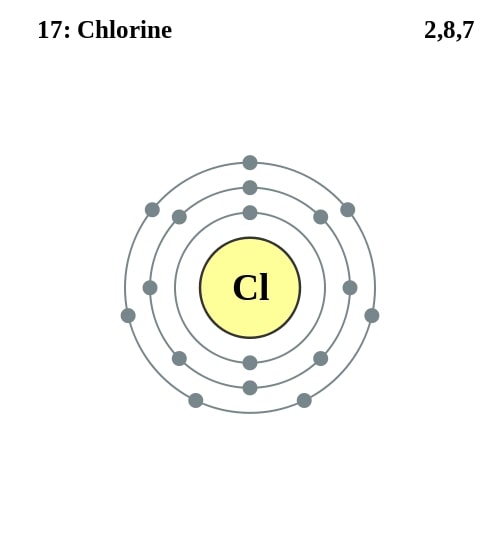
Elektronencofiguratie Bohr
2,8,7
Bij kamertemperatuur
gas
Elektronegativiteit
2,8 (Pauling)
Dichtheid
2.90 kg m-3 (Cl2)
Atoomstraal
99 . 10-12m
Smeltpunt
-101 oC (172 K)
Relatieve atoommassa
35.453
Kookpunt
-34 oC (239 K)
Soortelijke warmte
490 J kg-1K-1
Warmtegeleidingscoëfficiënt
0.0076 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Waterontsmetting
Voor de desinfectie van drink-, zwem- en rioolwater werd vroeger wel chloorgas gebruikt. Vanwege de strenge veiligheidseisen gebruikt men tegenwoordig vooral chloorbleekloog; een oplossing van natriumhypochloriet (NaOCl). In het huishouden kennen we dit als bleekwater.
De desinfecterende eigenschappen berusten op de oxiderende werking van de vrijkomende atomaire zuurstof. Die ontstaat bij toevoegen van chloor of hypochloriet aan water:
respectievelijk
De typische ‘chloorlucht’ in zwembaden, en ook de prikkelende werking op de ogen, komt voor rekening van chlooramines. Dat zijn verbindingen waarin chloor is gebonden aan een aminogroep (bijvoorbeeld RNHCl of R2NCl). Ze ontstaan bij de reactie met verontreinigingen die vaak het gevolg zijn van gebrek aan hygiëne, zoals niet douchen en geen toiletbezoek vóór het zwemmen.

De laatste jaren is er bij de drinkwaterzuivering een verschuiving te zien van het gebruik van chloor naar biologische zuivering, eventueel gecombineerd met oxidatie door ozon. Toch wordt soms nog chloor toegepast.
Chloorbleekloog wordt ook toegevoegd aan koelwaterinstallaties om algengroei en afzetting van schelpdieren tegen te gaan.
Bleekmiddel
Onder bleken verstaan we het zo wit mogelijk maken van gekleurde stoffen, bijvoorbeeld papier en textiel. De blekende werking berust op de oxiderende werking van chloor of van hypochloriet (OCl–; bleekwater is een oplossing van NaOCl).
Hypochloriet wordt al zeer lang als bleekmiddel gebruikt. Reeds kort na de ontdekking van chloor werd oplossing van kaliumhypochloriet als ‘liqueur de Javel’ op de markt gebracht (bleekwater wordt in sommige landen nog ‘eau de Javel’ of ‘Javel’ genoemd). Later werd het kaliumhydroxide vervangen door natriumhydroxide.
Zoutzuur
Dit is een oplossing van waterstofchloride-gas in water. Het gas is op verschillende manieren te verkrijgen:
1) Als bijproduct bij de vorming van gechloreerde organische verbindingen. Hierbij wordt tevens waterstofchloride gevormd, bijvoorbeeld:
2) Door waterstof te laten reageren met chloor (“verbranden” van chloor)
3) Door de reactie van een chloride (bijvoorbeeld NaCl of KCl) met geconcentreerd zwavelzuur. Dit proces levert zeer zuivere waterstofchloride op. Het vindt plaats in zogenaamde Mannheimovens en verloopt in twee stappen:
.

Zoutzuur wordt vooral gebruikt voor het verwijderen van oxidelagen van staal en andere metalen (het zogenoemde beitsen); voor de bereiding van metaalchloriden; voor het regenereren van ionenwisselaars; en verder voor tal van neutralisaties (bijv. van natrium- en calciumhydroxide-oplossingen).
Bij de mens speelt zoutzuur een essentiële rol in het spijsverteringsproces. In de maag verzorgt het de pH-regeling en de verdediging tegen allerlei bacteriën, die anders voedselvergiftiging zouden veroorzaken.
Plastic (PVC)
Polyvinylchloride (PVC), is één van de meest gebruikte kunststoffen. De grondstof is vinylchloride, dat ontstaat bij de reactie tussen etheen en chloorgas of zoutzuur:
of
gevolgd door
Bij polymerisatie van het vinylchloride ontstaat PVC:
PVC wordt gebruikt voor verpakkingsmateriaal, zoals folie, blisterverpakking, doordrukverpakking voor geneesmiddelen en zakken voor infuusvloeistof en bloed.

Het gebruik van PVC heeft een aantal jaren ter discussie gestaan vanwege de verwerking in vuilverbrandingsinstallaties. Bij onvolledige verbranding kan het aanleiding geven tot de vorming van dioxines, maar uit onderzoek is gebleken dat dit risico niet hoger is dan bij de verbranding van allerlei andere organische afvalstoffen.
Chloor speelt overigens op veel grotere schaal een rol in de kunststofindustrie. Het wordt gebruikt bij de bereiding van (tussenproducten voor) allerlei andere polymeren, zoals epoxyhars, polyurethaan, polycarbonaat en siliconen.
Chemisch reinigen
Bij de ‘stomerij’ maakt men in veel gevallen gebruik van drycleaning, een proces dat in het dagelijks leven meestal met chemisch reinigen wordt aangeduid. Hierbij past men perchlooretheen of tetrachlooretheen toe. Het gebruik van deze oplosmiddelen is aan wettelijke regels gebonden en het verbruik is in de loop der jaren jaren sterk afgenomen, dankzij een toenemend hergebruik en het gebruik van gesloten installaties.

Geneesmiddel
Chloor staat aan de basis van veel geneesmiddelen. Het merendeel (naar schatting zo’n 85%) bevat chloor of wordt met behulp van chloorhoudende tussenproducten gemaakt.
Denk daarbij aan cytostatica die de celgroei en celdeling van tumoren remmen: chloorambucil (C14H19NO2Cl2) en chloormethinehydrochloride (C5H11NCl2.HCl). Ze worden gebruikt in de chemotherapie.
Verder antiseptica zoals chloorhexidinedigluconaat (C22H30N10Cl2.2C6H12O7) dat als ontsmettingsmiddel dient voor huid, wonden en slijmvliezen. Enkele andere antiseptica zijn: benzalkoniumchloride, natriumhypochloriet en chloorxylenol (C8H9ClO, bekend als Dettol®).
Ook in antibiotica (infectiebestrijding), diuretica (plastabletten), bloeddrukverlagers en anti-psychotica kan chloor een rol spelen.

Meer toepassingen
Als element en in legeringen
- Bereiding van chloorverbindingen (PCl3; PCl5; diverse organische chloorverbindingen)
- Bereiding van titaandioxide
- Winnen van metalen
In verbindingen
| Antitranspiratiemiddel in deodorant | AlCl3, Al2(OH)5Cl |
| Batterij | NH4Cl |
| Behandeling van huidaandoeningen | SbCl3 |
| Beitsmiddel | FeCl2, FeCl3 |
| Bleken van meel, vet, olie, textiel, papier | Chlooroxiden, bijv. ClO2 |
| Bleken van textiel | TiCl3 |
| Bloedstelpend middel | CaCl2 |
| Bloedstolling | FeCl3 |
| Blusmiddel (toevoeging) | LiCl, MgCl2, CaCl2 |
| Conservering van wijn | Chloorazijnzuur |
| Etsen van glas | TiCl4 |
| Lenzen voor IR-camera’s en -spectroscopie | TlCl, Na- of KCl |
| Metaal-etsmiddel | FeCl3 |
| Mottenballen | 1,4-dichloorbenzeen |
| Ontkleuring van plantaardige olie | FeCl3 |
| Ontspiegelen van lenzen | TiCl4 |
| Sproeien van droge wegen om stuiven tegen te gaan | CaCl2 |
| Traangas | Chlooracetofenon (C6H5COCH2Cl) en chlooraceton (CH3COCH2Cl) |
| Verfbereiding | SnCl2 |
Naam & ontdekking
Naam
De naam chloor komt van het Griekse woord chlôrós, voor geelgroen. Deze naam werd in 1811 door de Britse chemicus Humphry Davy voorgesteld. Hij vond de kleur van het chloorgas overeenkomen met de kleur van jonge planten of jong gras.
Ontdekking
Chloor werd in 1774 ontdekt door de Zweedse chemicus Carl Wilhelm Scheele (foto) toen hij ‘zeezuur’ (zoutzuur) liet reageren met bruinsteen. Scheele verkeerde in de veronderstelling met een verbinding van zuurstof van doen te hebben. Het lukt echter niemand om dat aan te tonen. In 1810 concludeerde Humphry Davy als eerste dat chloor een element was.

Voorkomen
Voorkomen
Het zal geen verbazing wekken dat vooral in de oceanen veel chloor te vinden is. Het is daar na zuurstof en waterstof het meest voorkomende element met een gewichtsaandeel van bijna 2%. Dat komt door opgeloste zouten: vooral natriumchloride maar ook kaliumchloride en magnesiumchloride. Zeeën en oceanen bevatten zo’n 30 tot 40 gram zout per liter.

In de aardkorst is chloor het 19e element in de rangorde van voorkomen, met een aandeel van 1,45.10-2 %. Ook daar is het vooral te vinden als natriumchloride, onder andere in mineraal steenzout en in aardlagen.
De belangrijkste mineralen zijn:
| Bischofiet | MgCl2.6H2O |
| Carnalliet | KMgCl3.6H2O |
| Haliet (of steenzout) | NaCl |
| Kaïniet | MgSO4. KCl.3H2O |
| Sylvien | KCl |
| Sylviniet | KCl.NaCl |
| Tachyhydriet | CaMg2Cl6.12H2O |
Chloor komt voor in gassen die vrijkomen uit vulkanen. In deze gassen komt tevens waterstofchloride voor. In bronnen in de omgeving van vulkanen wordt zoutzuur aangetroffen.
Winning
De oudste zoutlagen zijn van Cambrische oorsprong en worden gevonden in de Punjab (India), de ‘Salt Range’ (Verenigde Staten van Amerika) en in Siberië (Rusland). In Nederland komen zoutlagen voor in de zogenoemde Zechsteinformaties, het Bovenbontzandsteen (Röt) en de Muschel-kalkformatie.
Steenzout wordt op zeer vele plaatsen gewonnen in de vorm van vast zout. De belangrijkste mijnen bevinden zich in Oostenrijk, Duitsland, Polen en de Verenigde Staten van Amerika.
Zeezout wordt in “warme landen” als Spanje, Portugal en Frankrijk gewonnen door verdamping van zeewater.

Verder kan zout worden gewonnen door het oplossen van zout dat zich in (diepere) grondlagen bevindt. Hierbij wordt water door de zoutlagen gepompt. Vervolgens wordt de verkregen zoutoplossing (pekel) gezuiverd en ingedampt. Dit gebeurt in Nederland door Akzo Nobel (onder andere bij Boekelo) en door Frisia Zout (bij Pietersbierum).
Bereiding
Bereiding
Vroeger
Chloor werd bereid uit bruinsteen (MnO2) en zoutzuur:

Tegenwoordig
Chloor wordt vooral bereid door elektrolyse van oplossingen van natrium- en kaliumchloride. Er zijn drie processen:
Kwikelektrolyse
Dit vindt plaats in een elektrolysevat met een positieve pool van titaan (met een coating van zeldzame aarden) en een negatieve pool van (stromend) kwik. Aan de positieve pool ontstaat dan het chloorgas. Aan de negatieve pool vindt een reactie plaats met het natriumion, waarbij natriumamalgaam wordt gevormd. Als dit amalgaam door een tweede reactievat (de zogenoemde loogcel) wordt geleid, reageert het natrium met water tot natronloog en waterstof. Door deze opstelling met twee cellen blijft het waterstofgas gescheiden van het chloorgas.
Overzicht van de reacties:
in de elektrolysecel:
+pool :
– pool :
in de loogcel:
Diafragmaproces
Dit gebeurt in een elektrolysevat met een positieve pool van titaan en een negatieve pool van staal. De elektroden zijn gescheiden door een zogenoemd diafragma – een alleen voor vloeistoffen doorlaatbare wand. De gassen die bij de elektrolyse ontstaan (waterstof en chloor) blijven zo gescheiden. Door toepassing van het tegenstroomprincipe wordt voorkomen dat de aan de negatieve pool gevormde hydroxide-ionen bij de positieve pool terechtkomen. De chloride-ionen kunnen echter wel door het diafragma, waardoor de gevormde natronloog licht verontreinigd zal zijn met chloride.
Overzicht van reacties:
+ pool :
– pool :
Membraanproces
Dit is het modernste proces en tegenwoordig de eerste keuze bij nieuwe installaties. Het werkt in feite net als het diafragmaproces, alleen laat het membraan in tegenstelling tot het diafragma (vrijwel) uitsluitend positieve ionen door, waardoor vrij zuivere natronloog wordt gevormd.
Bij het diafragma- en het membraanproces is het energieverbruik bij de elektrolyse veel lager dan bij het kwikelektrolyseproces.