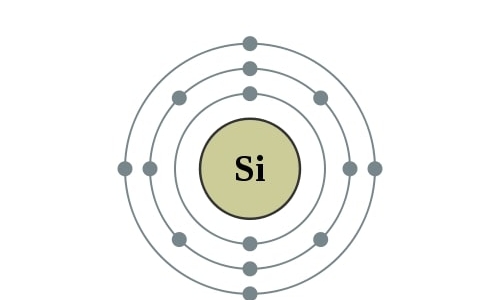
Op zuurstof na is silicium het meest voorkomende element op aarde. Silicium is verantwoordelijk voor een ruim een kwart van het gewicht van de aardkorst. Je vind het vooral als oxide, zoals in zand, kwarts, amethist en agaat. Het meeste gesteente op aarde bestaat uit silicaten. Chemisch gezien lijkt silicium erg op koolstof. Je kunt er net als van koolstof polymeren van maken, onder andere voor siliconenkit. Silicium is hét materiaal van de elektronica-revolutie en is ook te vinden in zonnecellen. Het extreem harde silliciumcarbide is één van de meest gebruikte schuur- en slijpmiddelen.
Symbool
Si
Protonen/elektronen
Groep
Isotopen
28Si, 29Si, 30Si
Periode
3
Elektronenconfiguratie
[Ne] 3s2 3p2
Blok
p
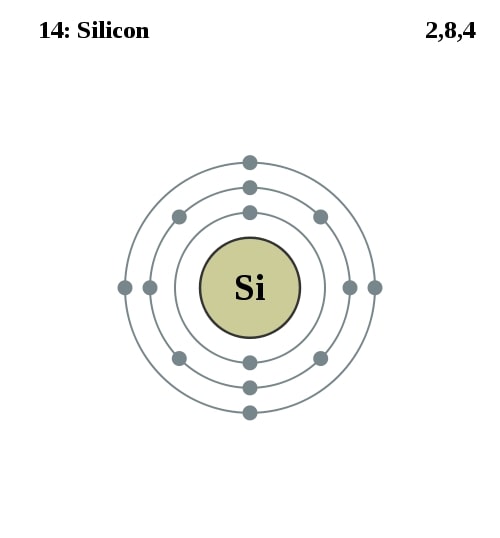
Elektronencofiguratie Bohr
2,8,4
Bij kamertemperatuur
vast
Elektronegativiteit
1,7 (Pauling)
Dichtheid
2330 kg m-3
Atoomstraal
117 . 10-12 m
Smeltpunt
1414 oC (1687 K)
Relatieve atoommassa
28.086
Kookpunt
3265 oC (3538 K)
Soortelijke warmte
760 J kg-1K-1
Warmtegeleidingscoëfficiënt
148 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Chip, zonnecel
De kristalvorm van silicium is dezelfde als van diamant: tetraëdisch. Het is een halfgeleider. Dit houdt in dat de geleidende eigenschappen van silicium te veranderen zijn door dopen. Daarbij wordt een deel van de siliciumatomen in het kristalrooster vervangen door andere elementen. Veelgebruikte dopants zijn fosfor en boor. In het eerste geval ontstaat een elektronoverschot – fosfor heeft één valentie elektron meer dan silicium. Bij dopen met boor ontstaat een elektrontekort (een zogenoemd gat). De geleiding in een halfgeleider vindt dan ook plaats door elektronen of door gaten, afhankelijk van het type dopant. Men spreekt dan van respectievelijk n-silicium en p-silicium.

Van het verschil in elektrische eigenschappen tussen n- en p-silicium wordt handig gebruik gemaakt bij de productie van computerchips en andere geïntegreerde elektronische schakelingen (IC’s). Deze bestaan uit uitgekiende afwisselingen tussen p-type en n-type halfgeleiders en laagjes isolatormateriaal. Afhankelijk van de geometrie ontstaan zo microscopisch kleine elektronische componenten, zoals diodes en transistoren. Met de huidige fabricagetechnieken zijn details te bereiken van minder dan een tiende micrometer. Hoe kleiner de details, hoe hoger de dichtheid van de componenten op een chip. Dit houdt weer verband met parameters als geheugencapaciteit en processorsnelheid.
Ook bij de meest gebruikte zonnecellen spelen de halfgeleidende eigenschappen van silicium een bepalende rol. Ze zijn verantwoordelijk voor het zogenaamde fotovoltaïsche effect waarbij invallend licht leidt tot een spanningsverschil tussen de twee verschillende typen halfgeleider.

Het zonlicht maakt zowel elektronen als gaten vrij in respectievelijk het n- en p-silicium. Een depletielaag tussen beide materialen zorgt voor scheiding van de beide ladingsdragers. Het resultaat is een spanningsverschil over de zonnecel: licht-energie is omgezet in elektrische energie.
Gereedschap
Siliciumcarbide (SiC) is een zeer hard materiaal, met dezelfde kristalstructuur als diamant. Het wordt gebruikt in gereedschappen en machineonderdelen, die bij zeer hoge temperatuur moeten functioneren. Je vindt het bijvoorbeeld ook in de keramische remschijven van (super)sportauto’s. Ook in het hitteschild van de spaceshuttle werd SiC verwerkt.
Zeer fijn verdeeld siliciumcarbide is een veelgebruikt schuur-, slijp- en polijstmiddel en verhardingsmiddel (bijvoorbeeld in de cementen slijtlaag op vloeren).
Siliciumcarbide wordt gemaakt uit siliciumdioxide (kwartszand) en koolstof, in een elektrische oven:
Ook siliciumnitride (Si3N4) wordt toegepast in producten die duurzaam en zeer slijtvast moeten zijn en onder extreem hoge belastingen moeten functioneren. Denk daarbij aan gereedschap voor metaalbewerking, maar ook aan onderdelen voor turbines en automotoren en afsluitingen van kogellagers.

Zand/glas
Glas wordt – al vele eeuwen lang – gemaakt door zand (SiO2) te smelten met calciumcarbonaat (CaCO3) en natriumcarbonaat (soda, Na2CO3). Bij de hoge temperaturen ontleden deze stoffen waardoor uiteindelijk een mengsel van oxiden ontstaat. Daarbij raakt de hechte kristalstructuur het siliciumdioxide verbroken en de metaaloxiden worden in het rooster opgenomen. Bij afkoelen ontstaat dan geen kristallijne stof meer, maar een amorfe stof (onderkoelde vloeistof) met een bijzonder hoge viscositeit. Het verkregen materiaal, glas, is hard en transparant.
Door toevoegen van andere oxiden ontstaat glas met een speciale eigenschap of kleur. Zo leidt loodoxide tot kristalglas en booroxide tot hittebestendig glas (zoals bijvoorbeeld Pyrex®). Toevoegen van Fe3+-verbindingen maakt het glas groen.. De groenige glans van (dik) vensterglas is het gevolg van sporen ijzerverbindingen.
Voor optische glasvezelkabels, waarin lichtpulsen zich vele kilometers kunnen voortplanten, is zeer zuiver kwartsglas nodig. Dit glas wordt gemaakt door zeer zuiver siliciumchloride (SiCl4) te laten reageren met zeer zuivere zuurstof.

Kwarts
Kwarts is een vorm van siliciumdioxide (SiO2) en behoort tot de meest voorkomende stoffen op aarde. Je vind het in alledaagse stoffen als zand en klei en in diverse soorten mineralen, die – afhankelijk van de bouw en de aanwezigheid van sporen van metalen – prachtige kristalvormen in schitterende kleuren opleveren. Kwarts is daarom veel in sieraden te vinden.
Cement/beton
Cement is één van de belangrijkste stoffen in de bouwwereld. Het wordt onder meer gebruikt als ‘lijmmiddel’ bij het metselen van (bak)stenen en bij het aanmaken van beton.
De belangrijkste bestanddelen van cement zijn krijtsteen (CaCO3) en klei- of leemachtig materiaal met oxiden van silicium en aluminium. Na mengen, malen en drogen wordt het mengsel zeer sterke verhit. Dat leidt tot de vorming van voornamelijk calciumsilicaat (CaSiO3) en calciumaluminaat (Ca3(AlO3)2). Dit wordt vervolgens samen met enkele toeslagstoffen zoals gips zeer fijn gemalen tot cementpoeder.
Het poeder dient als bindmiddel in metselspecie, die verder nog zand en water bevat. Het water brengt hydratatiereacties in het cement op gang, waardoor de specie uithardt. Beton wordt gemaakt uit cement, zand en grind in een verhouding van ongeveer 1:2:3.
Siliconenkit
Siliconenkit is een bijzondere toepassing van silicium. Het is in feite een kunststof, een polymeer. De grondstof (monomeer) is dichloordimethylsilaan (CH3)2SiCl2, dat zelf een product is van de reactie tussen silicium en chlooralkanen over een koperoxide katalysator.

De polymerisatie van het monomeer verloopt als volgt:
.
De gevormde ketens bevatten zo’n 1000 – 2500 siliciumatomen. Afhankelijk van de samenstellingt noemt men het gevormde polymeer siliconenolie (vloeibaar) of siliconenvet (dikker). Siliconenolie wordt gebruikt in de olie-industrie, bij de verfproductie, in de levensmiddelen- en wasmiddelenindustrie en in de farmaceutische industrie.
Voor siliconenkit wordt een aangepast polymeer gebruikt waarbij de ketens onderling zijn te koppelen (vernetten). Hierbij ontstaat een moleculaire structuur met een driedimensionaal netwerk: de eigenlijke kit.
Hieronder vind je een voorbeeld van vernetting waarbij de polymeerketens over acetaatgroepen beschikken. Deze groepen reageren met waterdamp uit de lucht tot azijnzuur, waarbij een silicium-zuurstof-silicium koppeling wordt gevormd. Deze reactie is verantwoordelijk voor de zurige lucht die je vaak ruikt bij het uitharden van siliconenkit.
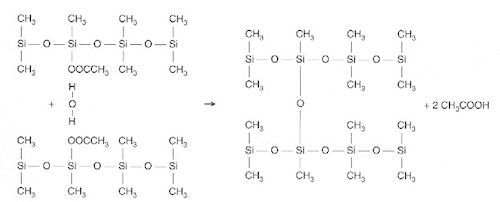
Deze siliconenkit wordt onder andere toegepast in de bouw (afdichten van kieren, lijmen van glas, waterafstotend maken van muren, enz.), de machinebouw en het impregneren van textiel. Omdat de waterdamp uit de lucht niet speciaal toegevoegd hoeft te worden spreekt men hier over een één-componentsysteem.
Er zijn ook tweecomponenten siliconenproducten; daarbij wordt vlak voor gebruikt een reagens door het polymeer gemengd. Deze ‘kitten’ vind je onder andere in de elektronische industrie en de bouw. En in de tandtechniek, bij het “happen”: in korte tijd is de siliconenmassa uitgehard en is de afdruk van het gebit gereed.
Meer toepassingen
Als element en in legeringen
- Isolator
- Sensoren voor de airbag en het ABS-remsysteem
- Spiegels in optische apparatuur (via opdampen van een laagje Si)
- Velgen (Al met 7 – 10 % Si)
In verbindingen
| Aardewerk | SiO2 |
| Antigraffiti producten | Siliconen |
| Antiklonteringsmiddel in koffiepoeder en zout | SiO2 |
| Antischuimmiddel | Siliconen |
| Cosmetica | Siliconen, talk |
| Droogmiddel | SiO2 |
| Geneesmiddel | |
| - Anti-flatulentiemiddel (tegen overmatige gasvorming) | Dimethicon1) en simethicon |
| - Catheter/hartklepdichting/implantaten/prothese | Siliconen (van elastomeren) |
| - Grondstof voor zalf | Siliconen |
| Haarlak of -gel | Siliconen |
| Kunstmatige nevel | SiCl4 |
| Melkglas | K2SiF6 |
| Porselein | SiO2 |
| Smeermiddel | Siliconen |
1) dimethylpolysiloxanen: siliconenoliën van diverse viscositeit; in de keten zitten voortdurend twee methylgroepen aan Si.
Naam & ontdekking
Naam
De naam silicium is afgeleid van het Latijnse woord silex (meervoud: silicis) voor kiezel, harde steen, keisteen of vuursteen. De naam werd al in 1808 voorgesteld door de Engelse natuur- en scheikundige Humphry Davy (foto), die één van de eerste pogingen ondernam het element te isoleren.

Ontdekking
Silicium is onderdeel van kiezel (siliciumdioxide), dat als materiaal reeds in de Oudheid bekend was. De alchemisten beschouwden kiezel al als een element. (Bij wel meer elementen (net name de zeldzame aarden) geldt de ontdekking van het oxide als de ontdekking van het element.)
Humphry Davy veronderstelde als eerste dat kiezel geen element maar een verbinding is. Met silicium, een metallisch element, als één van de bestanddelen.
De Franse chemici Joseph Louis Gay-Lussac en Louis Jacques Thénard maakten waarschijnlijk in 1811 al onzuiver amorf silicium, via de verhitting van kalium met siliciumtetrafluoride. Maar ze bekommerden zich verder niet om hun reactieproduct.
De ontdekking van sillicium wordt daarom toegeschreven aan de Zweedse scheikundige Jöns Jacob Berzelius, die in 1823 een vergelijkbare reactie uitvoerde van een siliciumverbinding met kalium. Hij zuiverde zijn reactieproduct via herhaaldelijk wassen tot een bruinig poeder: amorf silicium.
Het duurde nog 31 jaar voordat de Fransman Henri -tienne Sainte-Claire Deville er in slaagde sillicium in de nu bekende kristallijne vorm te verkrijgen.
Voorkomen
Voorkomen
Silicium komt voor in de zon en in sterren. Het is het hoofdbestanddeel van bepaalde meteorieten (aeroliten).
Op aarde is silicium op zuurstof na het meest voorkomende element in de aardkorst met een aandeel op basis van gewicht van 28,2%.
Zand bestaat voor het merendeel uit SiO2.

Silicium is in zeer veel mineralen te vinden, onder andere in:
| Agaat (foto) | SiO2 |
| Albiet | NaAlSi3O8 |
| Amethist | SiO2 |
| Beryl | Be3Al2Si6O18 |
| Biotiet | K(Mg,Fe+2)3(Al,Fe+3)Si3O10(OH,F)2 |
| Hemimorfiet | Zn4Si2O7(OH)2.H2O |
| Jadeïet | Na(Al,Fe+3)Si2O6 |
| Jaspis | SiO2 |
| Kwarts | SiO2 |
| Mica | {Na,K,Ca,Mg}{Al,Mg,Fe,Li}2-3{Si,Al}4O10{OH,F}2 |
| Onyx | SiO2 |
| Opaal | SiO2.nH2O |
| Orthoklaas | KAlSi3O8 |
| Petaliet | LiAlSi4O10 |
| Serpentijn | (Mg,Fe+2,Ni)3Si2O5(OH)4 |
| Sodaliet | Na8Al6Si6O24Cl2 |
| Talk of speksteen | Mg3Si4O10(OH)2 |
| Topaas | Al2SiO4(F,OH)2 |
| Zeoliet | Geen vaste formule; verhouding (Al+Si):O = 1 : 2 |
Winning
Siliciumdioxide kan vrijwel overal worden gewonnen, bijvoorbeeld als kwartszand. Belangrijke (zeer grote) wingebieden liggen in de Verenigde Staten van Amerika (Californië), Turkije en Rusland.
Het bekende Silicon Valley in Californië (iets ten zuiden van San Francisco) heeft niets met de winning met het element van doen, maar alles met de toepassing. Het is de bakermat van high tech bedrijvigheid in productie en toepassing van silicium computerchips.
De EU heeft met de Critical Raw Materials Act in 2022 het element silicium op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
Silicium werd in 1823 voor het eerst bereid door de Zweedse scheikundige Jöns Jacob Berzelius door reductie van kaliumsiliciumfluoride (K2SiF6) met gesmolten kalium. In 1854 slaagde de Fransman Henri -tienne Sainte-Claire Deville erin kristallijn silicium te verkrijgen.

Tegenwoordig
Silicium wordt gemaakt uit kwartszand (siliciumdioxide) in een elektrische oven met koolstofelektroden. Bij een temperatuur rond 1700 oC bindt zuurstof aan het koolstof en blijft zuiver silicium over:
Door er voor te zorgen dat er steeds voldoende siliciumdioxide aanwezig is (overmaat) wordt de vorming van siliciumcarbide vermeden. Eventueel gevormd siliciumcarbide wordt dan direct weer omgezet in silicium volgens de reactie
Het proces levert silicium dat voor ongeveer 96 – 99 % zuiver is. Voor toepassingen in elektronische componenten zoals computerchips is echter een véél grotere zuiverheid vereist, waarbij slechts één vreemd atoom mag voorkomen op 1010 siliciumatomen.
De vérgaande zuivering van silicium begint met het oplossen in zoutzuur. Daarbij treden de volgende reacties op:
en
Uit het reactieproduct wordt vervolgens via herhaald destilleren SiHCl3 geïsoleerd. De volgende stap, reductie met zeer zuiver waterstofgas, levert het zuivere silicium:
Het silicium is dan vloeibaar. Uit de smelt wordt een staafvormig éénkristal getrokken (tot ca. 20 cm doorsnede), dat via zonesmelten nogmaals wordt gezuiverd.

Ook via ontleding van siliciumjodide, via het Van Arkel-de Boer-proces is zeer zuiver silicium te verkrijgen. Dit proces werd in 1925 ontwikkeld door de Nederlandse chemici Anton Eduard van Arkel en Jan Hendrik de Boer. Dit betreft thermische ontleding van siliciumjodide in een inerte atmosfeer. Hiervoor wordt onzuiver silicium met wat jood in een vat met zeer lage druk gebracht. Bij ca. 200 °C reageert het silicium tot siliciumjodide. Dit verdampt, waarna het in de nabijheid van een gloeidraad bij zeer hoge temperatuur (ca. 1.300 °C) weer ontleedt in jood en silicium. Het gevormde silicium slaat neer op de gloeidraad.