Het grijsgrauwe mangaan lijkt op ijzer, maar is harder en bovendien erg bros. Ongeveer driekwart van de mangaanproductie wordt gebruikt in legeringen; het dient vooral als legeringselement in staal. Mangaan komt onder andere voor in ‘mangaanknollen’ op de bodem van de oceanen. Het speelt ook een belangrijke rol in de fotosynthese, in het bijzonder in de moleculaire complexen die energie uit zonlicht benutten om watermoleculen te splitsen. Mangaan werd in hetzelfde jaar ontdekt als zuurstof.
Symbool
Mn
Protonen/elektronen
Groep
Isotopen
55Mn
Periode
4
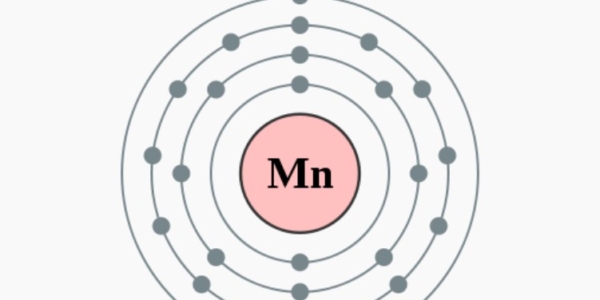
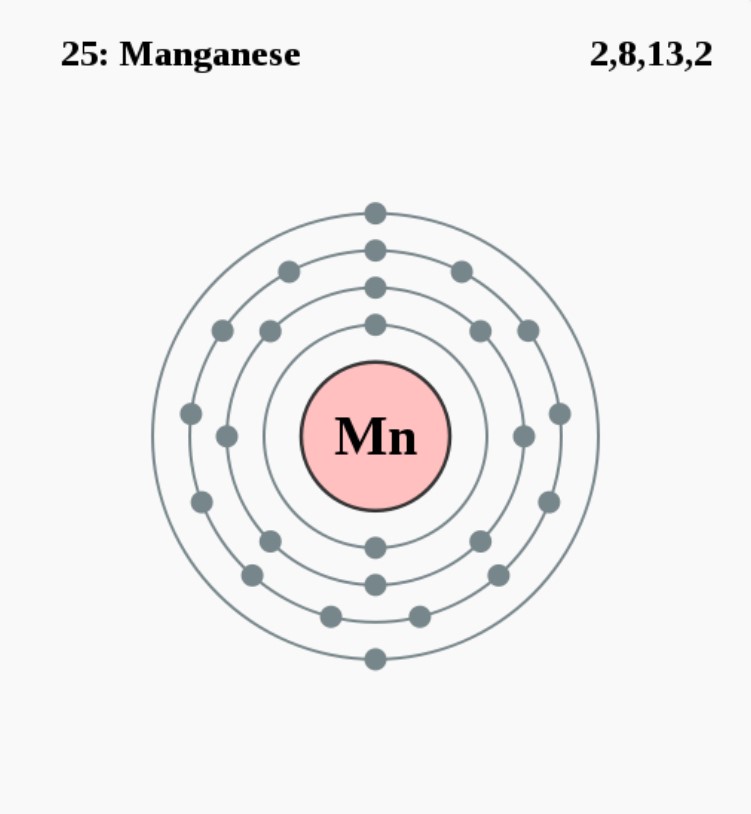
Elektronenconfiguratie
[Ar] 4s2 3d5
Blok
d
Elektronencofiguratie Bohr
2,8,13,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,6 (Pauling)
Dichtheid
7300 kg m-3
Atoomstraal
129 . 10-12 m
Smeltpunt
1246 oC (1519 K)
Relatieve atoommassa
54.938
Kookpunt
2061 oC (2334 K)
Soortelijke warmte
Warmtegeleidingscoëfficiënt
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Staal: railwissel, gereedschap, wielas, kluis, ploegijzer
Dit zijn allemaal toepassingen van Hadfieldstaal. Deze staalsoort bevat – naast ijzer – tot 14 % mangaan en 1,25 % koolstof. Het is ontwikkeld voor gebruik in situaties die hoge eisen stellen aan schok bestendigheid en slijtvastheid. Deze staalsoort is ook zeer goed bestand tegen weersinvloeden, hard en niet-magnetisch. Je vindt het ook in baggerwerktuigen en bepantseringsplaat. Een opmerkelijke toepassing van Hadfieldstaal is in tralies en deuren van gevangenissen. Bij een poging tot doorvijlen treedt plaatselijk verharding van het metaal op en wordt de vijl onbruikbaar.

Batterij
Mangaandioxide (MnO2 bruinsteen) wordt toegepast in de klassieke batterij volgens het principe van de cel van Leclanché. Deze bestaat uit een zinken omhulsel gevuld met onder meer bruinsteen (MnO2), een koolstaafje of koolpoeder, en ammoniumchloride, dat voor een goede geleiding van de stroom zorgt.
De cel is niet oplaadbaar, heeft een spanning van 1,5 V en kent een breed scala aan toepassingen. Deze batterijsoort wordt meer en meer vervangen door de alkalinebatterij, die volgens hetzelfde principe werkt.
Meststof
Mangaan is een zeer belangrijk (sporen)element voor planten, in het bijzonder in de teelt van groenten en citrusvruchten. Om tekort aan mangaan te voorkomen, wordt mangaansulfaat (MnSO4) of mangaanacetaat (Mn(CH3COO)2) toegevoegd.
Ook voor dieren en mensen is het een onmisbaar sporenelement, dat onder andere een rol speelt bij de opname van vitamine B1.
Pigment
Het gebruik van mangaanoxide als pigment stamt al uit zeer oude tijden. De Egyptenaren en Romeinen gebruikten het mangaanmineraal pyrolusiet bij de productie van glas, zowel om kleuren toe te voegen, als om kleuren te verwijderen.

Glas krijgt door toevoeging van mangaanoxide (MnO2, ook bekend als bruinsteen) een violette, bruine of zwarte kleur. De kleur is afhankelijk van de bereidingswijze en de samenstelling van het glas. Ook de specifieke violette kleur van de kwartssteen amethist is het gevolg van sporen mangaanverbindingen.
In keramische materialen zoals stenen en tegels zorgt bruinsteen (vaak in combinatie met andere metaaloxiden, zoals die van ijzer en chroom) voor een donkerbruine of zwarte kleur. Ook sommige soorten bakstenen worden gekleurd met bruinsteen. Het geeft de stenen een bijzondere kleur. Soms wordt dit soort stenen aangeduid als mangaansteen. Steenbakkerijen zijn grootverbruikers van bruinsteen.
Meer toepassingen
Als element en in legeringen
- Bimetaal in thermostaat (manganine: 72 % Mn, 18 % Cu, 10 % Ni)
- Brons (toevoegen van mangaan – 5 tot 15 % – verhoogt de weerstand tegen corrosie; bijv. voor schroeven, stuurinrichting e.d. die bestand moeten zijn tegen zeewater)
- Constructiestaal voor toepassingen met hoge belasting (staal met 1,5 % Mn)
- Elektrische weerstand (Mn, Ni, Cu)
- Fietsframe (licht en sterk; Al, Mn)
- Roestvrij en zeer hard staal (met 10 – 15 % Mn, 8 – 10 % Cr)
- Tandwiel voor geruisarme overbrenging (80 % Mn, 20 % Cu)
In verbindingen
| Drinkwaterzuivering (tabletten) | KMnO4, MnO2 |
| Droogmiddel in verf/lak | Mn(CH3COO)2, MnCl2, MnO2 |
| Etsmiddel voor rubber en plastics | KMnO4 |
| Groen pigment (bijv. in fresco’s) | BaMnO4 |
| Houtbeits | KMnO4, MnSO4 |
| Krachtvoer (toevoeging) | MnSO4MnCO3 |
| Leerlooien | Mn(CH3COO)2 |
| Vuurwerk | MnO2 |
Naam & ontdekking
Naam
De naam mangaan vind zijn oorsprong in Magnesia, een gebied in de Griekse provincie Thessalië. Ook het Griekse woord voor magneet, magnes, is daarvan afgeleid. Overigens is mangaan niet magnetisch!
In Magnesia werden verschillende mineralen aangetroffen: magnesia negra (zwart) en magnesia alba (wit). Dat laatste bleek het metaal te bevatten dat we tegenwoordig magnesium noemen. Uit het zwarte materiaal (tegenwoordig noemen we dat pyrolusiet) werd mangaan geïsoleerd. Hoe die extra n in de naam is geslopen is onduidelijk. De oudste beschrijving van manganesa komt van de laat zestiende-eeuwse Italiaanse wetenschapper Michele Mercati. Hij schreef het werk Metallotheca, dat pas in 1717 werd gepubliceerd.
Ons woord mangaan is weer een soort afkorting voor manganesium, de oorspronkelijke naam voor het element. Deze afkorting zorgt voor een duidelijker onderscheid met magnesium (element 12).
Ontdekking
De Duitse chemicus Johann Heinrich Pott stelde al in 1740 dat het mineraal pyrolusiet een nieuwe ‘aarde’ (oxide) bevatte. Tot dan toe werd er van uitgegaan dat het ijzerachtig mineraal zou zijn. Pott maakte kaliummanganaten door het mineraal te mengen met kaliloog (kaliumhydroxide). Uit de kleuren die hij daarbij zag leidde hij af dat er geen ijzer in zat.

De Oostenrijkse chemicus Ignatius Gottfried Kaim publiceerde in 1770 onderzoek waarbij hij (onzuiver) mangaan produceerde via behandeling met ‘zwarte flux’ – waarschijnlijk houtskool. Bekender is Johann Gottlieb Gahn (foto), de Zweedse chemicus/metallurg die in 1774 op vergelijkbare wijze metallisch mangaan maakte door reductie van het oxide met koolstof. Gahn, die samenwerkte met zijn landgenoten Carl Wilhelm Scheele en Tobern Olaf Bergman, wordt tegenwoordig als de ontdekker van mangaan beschouwd.
Voorkomen
Voorkomen
Het menselijk lichaam bevat ongeveer twaalf milligram mangaan, vooral in de botten, de lever en de nieren. Mangaan staat op plaats 25 van elementen die in het lichaam voorkomen
In de aardkorst is mangaan het op elf na meest voorkomende element. Het aandeel bedraagt 0,095 % op basis van gewicht.

Mangaan is te vinden in meer dan driehonderd mineralen. De belangrijkste zijn:
| Bixbyiet | (Mn+3,Fe+3)2O3 |
| Brauniet | Mn+2.Mn6+3SiO12 |
| Frankliniet | (Zn,Mn+2,Fe+2)(Fe+3,Mn+3)2O4 |
| Haueriet of mangaankies | MnS2 |
| Hausmanniet | Mn+2.Mn2+3O4 |
| Hübneriet | MnWO4 |
| Manganiet | Mn+3O(OH) |
| Psilomelaan | Ba2Mn5O10.2H2O |
| Pyrolusiet of bruinsteen | MnO2 |
| Rodochrosiet of mangaanspaat | MnCO3 |
| Rodoniet (foto) | (Mn+2,Fe+2,Mg,Ca)SiO3 |
Mangaan is ook vaak aanwezig in ijzer- en zinkertsen.
Winning
De belangrijkste wingebieden liggen in Oekraïne, China, Zuid-Afrika, Brazilië, Gabon, India, Georgië, Ghana, Australië, Japan en Zuid-Marokko. Mangaanerts is volgens de reguliere technieken te exploiteren bij een mangaangehalte van minstens 35 %.

Een andere geschikte bron lijken de zogenoemde mangaanknollen (foto) die op de oceaanbodem voorkomen. Deze bevatten – naast ijzer, nikkel, kobalt en koper – 1,5 tot 50 % mangaan. De commerciële winning van mangaan (en andere metalen) uit deze knollen is onderwerp van onderzoek. De voorraad op de oceaanbodem wordt geschat op minimaal 1.1012 ton.
Ook op de zon en in meteorieten is mangaan aangetoond. Men neemt aan dat de aardkern voor ongeveer anderhalf procent uit mangaan bestaat.
De EU heeft met de Critical Raw Materials Act in 2022 het element mangaan op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
De Zweedse chemicus/metallurg Johann Gottlieb Gahn maakte in 1774 metallisch mangaan door reductie van het oxide met koolstof. Het was niet bijzonder zuiver. Pas in 1930 werd echt zuiver mangaan verkregen door elektrolyse van mangaan(II)zouten.

Tegenwoordig
Bij de huidige mangaanproductie bereidt men meestal niet het zuivere metaal, maar legeringen met bijvoorbeeld ijzer, of ook wel silicium. In het geval van ijzer worden bruinsteen en ijzererts met cokes gereduceerd. Het product is ferromangaan, dat direct als metaal is te gebruiken. Maar het wordt vooral bij de staalproductie toegevoegd aan ruw ijzer om de juiste samenstelling te bereiken.
Uit mangaanerts als bruinsteen (MnO2) is zuiver mangaan te verkrijgen door het eerst om te zetten in Mn3O4 en dit vervolgens te reduceren met aluminiumpoeder:
Ook elektrolyse van mangaan(II)zouten levert zuiver mangaan op.