Gezien fluor extreem reactief is, kreeg het de bijnaam ‘de tijger van de chemie’. Het gele, corrosieve halogeengas reageert met vrijwel alle organische en anorganische stoffen. Metaal, glas, keramiek, koolstof en ook water brandt in fluor met een felle vlam. Het reageert zelfs met de edelgassen xenon, radon en krypton. Toegepast in verbindingen levert fluor materialen met bijzondere eigenschappen: non-stick, hard en vaak moeilijk afbreekbaar. Zowel elementair fluor als het fluoride-ion zijn toxisch. Pas nadat er grote behoefte aan fluor kwam voor de scheiding van uraniumisotopen (voor kernbommen en -energie) kwam het element in grote hoeveelheden beschikbaar.
Symbool
F
Protonen/elektronen
Groep
Isotopen
19F
Periode
2
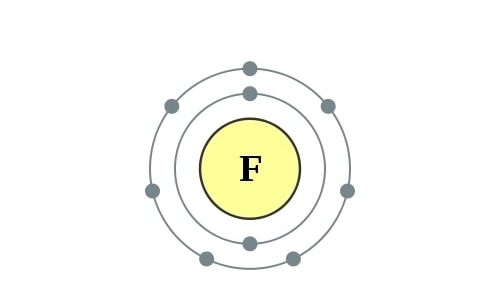
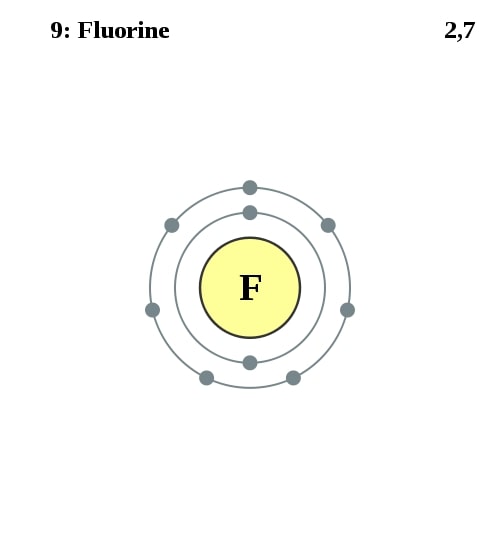
Elektronenconfiguratie
[He] 2s2 2p5
Blok
p
Elektronencofiguratie Bohr
2,7
Bij kamertemperatuur
gas
Elektronegativiteit
4,1 (Pauling)
Dichtheid
1,553 kg m-3 (F2)
Atoomstraal
64 . 10-12m
Smeltpunt
-219 oC (54 K)
Relatieve atoommassa
18.9984
Kookpunt
-188 oC (85 K)
Soortelijke warmte
820 J kg-1K-1
Warmtegeleidingscoëfficiënt
0.0176 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Tandpasta
Fluoride helpt tandbederf tegen te gaan. Tanden bestaan vooral uit hydroxyapatiet, dat gevoelig is voor cariës. Fluoride-ionen zetten het gedeeltelijk om in het zuurbestendige harde fluorapatiet:
De fluoridehoudende tandpasta’s kunnen daarnaast met het calcium uit het tandbeen calciumfluoride vormen, dat minuscule kanaaltjes in de tanden afsluit. De tanden worden zo minder gevoelig voor koude en zuur.

Fluor zit in tandpasta in de vorm van tinfluoride (SnF2) en natriumfluorfosfaat (Na2PO3F). Tandversterking met fluoride kan ook door ‘fluorapplicatie’ bij de tandarts of via de inname van fluortabletjes, die natriumfluoride (NaF) bevatten.
Bij het voorkomen van tandbederf speelt waarschijnlijk ook een rol dat fluor al bij een zeer lage concentratie (ongeveer 6 ppm, een honderdste van een honderdste van een procent) ongewenste bacteriën kan bestrijden.
Anti-aanbaklaag
De anti-aanbaklaag in braad- en koekenpannen bestaat uit polytetrafluoretheen (PTFE), beter bekend onder de merknaam Teflon®.

Deze kunststof ontstaat door polymerisatie van het monomeer tetrafluoretheen, (CF2= CF2) :
Het polymeer is zeer hard, inert en bestand tegen hoge temperaturen. Andere stoffen hechten nauwelijks aan PTFE. Naast koekenpannen vind je het ook in ruimtevaartpakken, beschermende overalls voor racewagenbestuurders en als bekleding van de wanden van chemische reactoren.
Blusmiddel
Fluorkoolstofverbindingen zorgen voor een flinke verlaging van de oppervlaktespanning van water en je vindt ze daarom in blusschuim voor de bestrijding van bijvoorbeeld vliegtuigbranden. Ze helpen een dikke schuimlaag te vormen die zich over de brandende kerosine kan verspreiden. De algemene chemische formule van fluorkoolstoffen is CnF2n+2. Ze vervangen de halonen (gehalogeneerde koolwaterstoffen, met name chloorfluorkoolwaterstoffen cfk’s) die schadelijk zijn voor de ozonlaag.

Verrijking van uranium
Natuurlijk uranium bevat slechts 0,7% van het isotoop 235U, dat cruciaal is voor de energieopwekking in kernreactoren. Fluor speelt een belangrijke rol in de technologie om het uranium te verrijken, dat wil zeggen het aandeel 235U te vergroten.
De scheiding van uraniumisotopen is bijzonder lastig. Ze zijn chemisch gezien hetzelfde en onderscheiden zich alleen door een minimaal verschil in massa. Het scheelt maar een paar neutronen op een atoomgewicht van 238; ongeveer een procent.
De aanpak om uraniumisotopen van elkaar op basis van massa te scheiden begint met het in de gasfase brengen van uranium. Het uraniumerts wordt daarvoor omgezet in het gasvormige uraniumhexafluoride (UF6, ook wel hexafluoruranium genoemd).
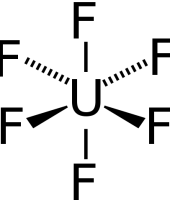
De reden om juist voor fluor te kiezen is dat dit element slechts als één natuurlijk isotoop voorkomt. Via ultracentrifugeren van het gas is het iets zwaardere 238UF6 te verwijderen, zodat het gas langzaam maar zeker rijker wordt aan 235UF6. Een aandeel van twee tot drie procent 235U is voldoende voor kernenergie. Voor een kernwapen moet de concentratie U-235 boven de 90 procent komen; het zogenaamde ‘weapons grade uranium’.
De omzetting van het uraniumerts (uraniumoxide) verloopt in twee stappen. Eerst wordt het met waterstoffluoride omgezet in uraantetrafluoride. In de volgende stap ontstaat via oxidatie met elementair fluor het gewenste uraanhexafluoride:
.
.
Na de verrijking is het uraanhexafluoride met waterstofchloride of jood te reduceren tot uraantetrafluoride, dat vervolgens met magnesium of calcium zuiver uranium oplevert.
Naam & ontdekking
Naam
De naam fluor komt van het Latijnse woord fluere, dat vloeien betekent. Dit vind je ook terug in de naam van het mineraal vloeispaat (fluoriet, CaF2, in het Engels: fluorspar). Het kreeg deze naam omdat het sinds de Middeleeuwen al gebruikt wordt als middel bij het bereiden van metalen. Het maakt de ‘slak’ vloeibaar, het afvalproduct dat vooral uit oxides bestaat. Ook de term fluorescentie komt trouwens van fluoriet. Al in de 17e eeuw werd ontdekt dat fluoriet licht uitzendt bij verhitting.
Ontdekking
De Duits-Zweedse chemicus Carl Wilhelm Scheele (foto) maakte in 1771 voor het eerst waterstoffluoride, via de reactie van fluoriden met geconcentreerd zwavelzuur. Hij concludeerde daarbij direct met een nieuw element van te doen te hebben.

Vanwege de enorme reactiviteit van fluor duurde het vervolgens meer dan een eeuw voordat iemand fluor in vrije toestand kon isoleren. Het lukte de Fransman Ferdinand Frederick Henri Moissan in 1886. Twintig jaar later, in 1906, kreeg hij daar de Nobelprijs voor. Zijn aanpak via elektrolyse van fluorhoudende verbindingen is nog steeds de belangrijkste industriële methoden om fluorgas te verkrijgen.
Voorkomen
Voorkomen
Het reactieve fluorgas komt in de natuur niet voor. Het element bestaat alleen in verbindingen, meestal mineralen zoals fluoriet (vloeispaat) en kryoliet (ijssteen). 0,0585 % van de aardkorst bestaat uit fluor en daarmee staat het op de 13e plaats op de lijst van meest voorkomende elementen.

De belangrijkste mineralen zijn:
| Bastnaesiet | (Ce,La)CO3F ; (Y,La)CO3F |
| Chioliet | Na5Al3F14 |
| Fluorapatiet | Ca5F(PO4) 3 |
| Fluoriet of vloeispaat | CaF2 |
| Kryoliet of ijssteen | Na3AlF6 |
| Sellaite | MgF2 |
| Topaas | Al2SiO4(F,OH)2 |
Winning
De belangrijkste wingebieden voor fluorhoudende mineralen liggen in Noord-Afrika, Noord-Amerika, een aantal eilanden in de Stille Oceaan, Rusland (Siberië), Spanje, Thailand, Frankrijk, China, Engeland, Italië, Groenland, Zuid-Afrika, Duitsland, Nigeria, Brazilië en Japan. Het is ook mogelijk om fluorhoudende gesteenten en mineralen van de oceaanbodem te halen.
De EU heeft met de Critical Raw Materials Act in 2022 het element fluor op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
De Franse chemicus Henri Moissan (foto) maakte in 1886 als eerste fluor, via elektrolyse van een oplossing van kaliumfluoride (KHF2) in watervrij waterstoffluoride (HF). Hij gebruikte daarvoor een platina U-buis met platina-iridium elektroden en fluorietafdichtingen, bij een temperatur van -50 ºC. In 1906 ontving hij – vooral voor deze ontdekking – de Nobelprijs voor scheikunde.

Tegenwoordig
Ook vandaag de dag wordt fluor gemaakt via elektrolyse. Bijvoorbeeld uit gesmolten alkaliwaterstoffluoriden (bijv. KF.3HF) in een koperen vat. Het vat dient als negatieve pool en voor de positieve pool gebruikt men nikkel. Ook apparatuur uit staal of aluminium wordt toegepast.