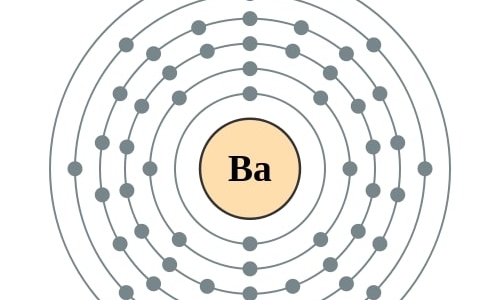
De naam van barium, het zwaarste stabiele aardalkalimetaal, is afgeleid van barys, het Griekse woord voor zwaar. ‘Bologna-stenen’ – lichtgevende kiezels – waren al in de middeleeuwen bekende bariumhoudende stenen. In 1774 werd het element (in de vorm van zijn oxide) voor het eerst uit de mineralen geïsoleerd. Barium is een zilverwit vervormbaar metaal dat in lucht direct dof wordt.
Symbool
Ba
Protonen/elektronen
Groep
Isotopen
130Ba, 132Ba, 134Ba, 135Ba, 136Ba, 137Ba, 138Ba
Periode
6
Elektronenconfiguratie
[Xe] 6s2
Blok
s
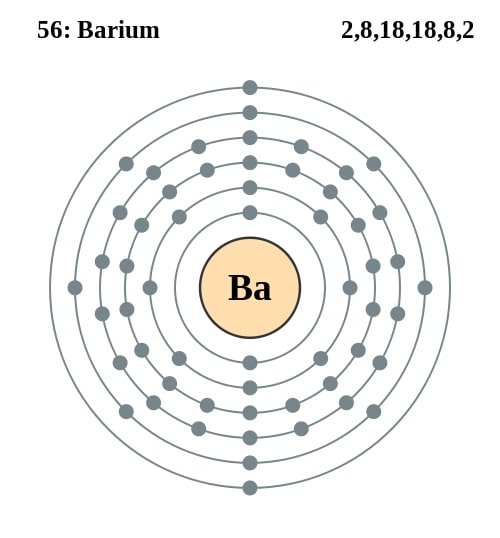
Elektronencofiguratie Bohr
2,8,18,18,8,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,0 (Pauling)
Dichtheid
3620 kg m-3
Atoomstraal
217 10-12m
Smeltpunt
727 oC (1000 K)
Relatieve atoommassa
137.34
Kookpunt
1897 oC (2170 K)
Soortelijke warmte
204 J kg-1K-1
Warmtegeleidingscoëfficiënt
18 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Gasvanger radiobuis
Barium dient als gasvanger (getter) in luchtledige elektronenbuizen (bekend van de ‘ouderwetse’ radiobuizen). Het bindt zuurstof, stikstof en waterstof. De damp van barium reageert met deze restgassen en de hierbij gevormde vaste stoffen zetten zich als spiegel op de glaswand af.

Smeermiddel(additief)
Bariumstearaat en bariumlauraat worden gebruikt als smeermiddel in vliegtuigen en vrachtwagens en in de industrie. Ze zijn bestand tegen relatief hoge temperaturen (tot ca. 150 °C).
Vul- en kleurstof voor papier
Het papierpigment ‘blanc fixe’ heet ook wel permanent wit of barietwit – dat laatste omdat het voornamelijk uit bariumsulfaat (BaSO4) bestaat. Dat is bestand tegen licht en lucht en dient behalve als pigment ook als vulstof. Je vindt het ook in fotografisch papier (vanwege het grote reflecterende vermogen), in katoen, behangselpapier, verf, kunststof, rubberartikelen, glas, kit en sierpleister.

Vuurwerk
Bariumchromaat (BaCrO4) zorgt in vuurwerk voor een speciale groene kleur. Bariumnitraat (Ba(NO3)2) is om die reden vaak in Bengaals vuur te vinden. Ook bariumchloraat (Ba(ClO3)2) wordt veel in vuurwerk toegepast. Het dient dan ook als zuurstofleverancier. In lichtkogels dient bariumperoxide (BaO2) als oxidator.
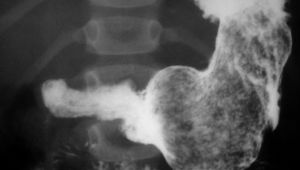
Maagfoto
Bariumpap (BaSO4) is een veelgebruikt contrastmiddel voor het maken van röntgenfoto’s bij onderzoek van het spijsverteringskanaal.
Glas
Bariumverbindingen (oxides, hydroxides en carbonaten) verhogen de brekingsindex en hardheid van het glas. Dit glas wordt gebruikt voor glasvezelkabels, breekbare lampen en speciale lenzen. Ook remt bariumglas de röntgenstraling; het is daarom te vinden in ‘ouderwetse’ beeldschermen en TV’s met een kathodestraalbuis. Bariumglas is ook een alternatief voor kristalglas in kroonluchters.
Pigment
Diverse bariumverbindingen dienen als pigment. Barietgeel (BaCrO4) is te vinden in glas, keramiek en porselein. Voor wit keramiek wordt onder meer bariumcarbonaat (BaCO3) gebruikt. Het verfpigment lithopoonwit is een mengsel van bariumsulfaat (BaSO4) en zinkzulfide (ZnS). Het maakt verf ongevoelig voor de inwerking van zwavelverbindingen.

Boormodder
Bij olie- en gasboringen wordt –boormodder– gebruikt, een geconcentreerde oplossing van bariet (bariumsulfaat, BaSO4) met een hoge dichtheid. Ze zorgen voor een voldoende hoge spoelingsdruk onderin het boorgat. Tachtig procent van het geproduceerde bariet wordt hiervoor gebruikt.
Meer toepassingen
Als element en in legeringen
- desoxidatiemiddel bij staalbereiding
- harden van lood (bv voor accu’s)
In verbindingen
| betontoevoeging (voor afscherming in kernreactoren) | BaSO4 |
| bleekmiddel voor stro, zijde | BaO2 |
| droogmiddel | BaO |
| explosieven | BaO2 |
| fruit- en wijnbouwbeschermingsmiddel | bariumpolysulfiden |
| gasdroogmiddel | Ba(ClO4)2 |
| harden van staal | BaCl2 |
| keramiek | BaCO3 |
| keramische magneet | bariumferriet |
| licht- en warmtebescherming in kunststoffen | BaO |
| lucifers | BaCrO4 |
| ontkleuring van loodglas | BaO2 |
| rattengif | BaCO3 |
| reinigen van olie | Ba(OH)2 |
| scheerpoeder | BaS |
| waterafstotend maken van textiel | bariumstearaat |
| waterontharder | BaCl2, Ba(OH)2 |
Naam & ontdekking
Naam
De naam barium is afgeleid van het Griekse woord barys, dat zwaar betekent. Al vóórdat het element zelf werd geïsoleerd noemde men het oxide al bariet.
Ontdekking
De in de middeleeuwen bekende ‘Bologna-stenen’ – lichtgevende kiezels – bevatten bariummineralen. In 1602 werd daar voor het eerst serieus studie van gemaakt door de Italiaanse schoenmaker en alchemist Vicenzo Casciarola.

In 1774 isoleerde de Duits-Zweedse chemicus Carl Wilhelm Scheele (foto) voor het eerst bariumoxide. Hij toonde hij aan dat het een tot dan toe onbekend oxide betrof. De Britse chemicus Humphry Davy was in 1808 de eerste die metallische barium verkreeg, via elektrolyse van gesmolten bariumzouten.
Voorkomen
Voorkomen
Barium staat op plaats veertien in de lijst van meest voorkomende elementen in de aardkorst, met een gewichtsaandeel van 0,0425%.

Het is te vinden in vele mineralen, zoals:
| bariet of zwaarspaat (foto) | BaSO4 |
| norsethiet | BaMg(CO3)2 |
| sambortiet | BaSi2O5 |
| witheriet | BaCO3 |
Winning
De belangrijkste wingebieden liggen in China, Rusland, Mexico, India, Turkije, de Verenigde Staten van Amerika, Ierland, Thailand, Frankrijk, Duitsland, Italië, Marokko en verschillende andere plaatsen in Noord-Afrika.
De EU heeft met de Critical Raw Materials Act in 2022 het element barium op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
De Britse chemicus Humphry Davy maakte in 1808 het eerste (redelijk onzuivere) metallische barium via elektrolyse van een mengsel van vochtig bariumhydroxide en kwikoxide. Hij verkreeg vooral bariumamalgaam, de verbinding met kwik.
De Duitse chemicus Robert Bunsen slaagde er in 1855 in, samen met zijn Britse collega Augustus Matthiessen, zuiver barium te verkrijgen door elektrolyse van een mengsel van gesmolten barium- en ammoniumchloride.

Tegenwoordig
Tegenwoordig maakt men barium uitgaand van bariumcarbonaat. Dat levert bij sterke verhitting in de aanwezigheid van koolstof zuiver bariumoxide:
dat vervolgens met silicium of aluminium wordt gereduceerd bij een temperatuur van ca. 1.100 °C (in vacuüm). Hierbij ontstaat zuiver barium, dat bij deze temperatuur wordt afgedestilleerd:
Barium is ook te verkrijgen door elektrolyse van gesmolten bariumchloride.