Het radioactieve astaat is bijzonder zeldzaam vanwege de korte halfwaardetijd van alle isotopen. Schattingen van de aanwezigheid in de gehele aardkorst lopen uiteen van een tiende gram tot hooguit enkele tientallen grammen. Het is het laatste element waarvan de ionisatie-energie werd gemeten, in 2013 door onderzoekers van CERN in Genève.
Symbool
At
Protonen/elektronen
Groep
Isotopen
210At, 211At
Periode
6
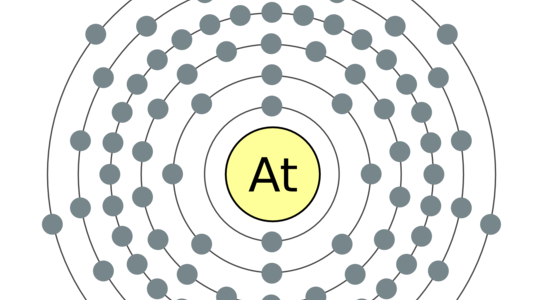
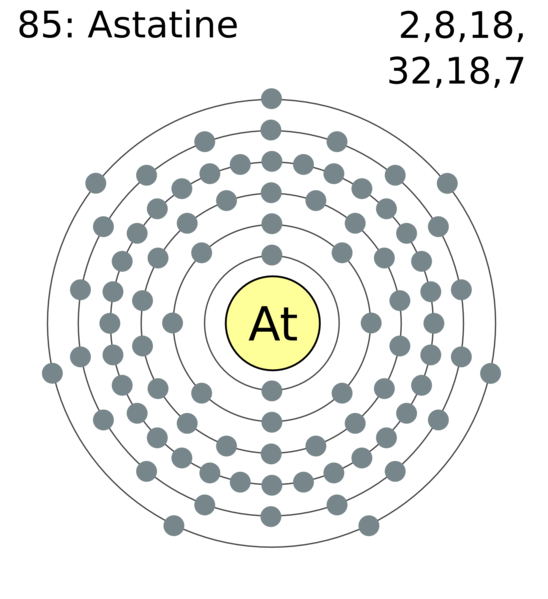
Elektronenconfiguratie
[Xe] 4f145d106s26p5
Blok
p
Elektronencofiguratie Bohr
2,8,18,32,18,7
Bij kamertemperatuur
vast
Elektronegativiteit
2,0 (Pauling)
Dichtheid
–
Atoomstraal
140 10-12m
Smeltpunt
302 oC (575 K)
Relatieve atoommassa
210
Kookpunt
337 oC (610 K)
Soortelijke warmte
–
Warmtegeleidingscoëfficiënt
–
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Er zijn geen toepassingen van astaat.
Naam & ontdekking
Naam
De naam astaat komt van het Griekse woord astatos voor instabiel. Alle bekende astaat-isotopen zijn instabiel
Ontdekking
Naar astaat is lang gezocht. De plek in het periodiek systeem onder jood bleef lange tijd leeg vanwege de instabiliteit van het element, waarvan het bestaan al door Mendelejev was voorspeld. Er zijn ook verschillende ‘valse’ ontdekkingen geweest van dit element, dat lange tijd door het leven ging als het illustere eka-jood.

Uiteindelijk slaagden de Amerikaanse deeltjesfysici Dale Corson (foto), Kenneth Ross MacKenzie en Emilio Segrè (foto) er in 1940 in om het element te ‘synthetiseren’ in het cyclotron van de Universiteit van Californië in Berkeley (Verenigde Staten) (foto). Ze maakten het isotoop astaat-211 (halveringstijd 7,21 uur) door een bombardement van bismuth-209 met alfa-deeltjes.

Voorkomen
Voorkomen
Astaat komt op aarde voor in onvoorstelbaar kleine hoeveelheden, naar schatting 3.10-24 % van de aardkost. Schattingen lopen uiteen van een tiende gram tot hooguit enkele tientallen grammen voor de gehele aardkorst. Lang had astaat de status van meest zeldzame element. Nu denkt men dat er nog kleinere hoeveelheden berkelium natuurlijk voorkomen, als gevolg van neutronenreacties in uraniumerts. De voornaamste astaatisotoop is 219At. Alle isotopen zijn radioactief.
Bereiding
Bereiding
Astaat werd voor het eerst bereid door 209Bi met a-deeltjes te beschieten in een cyclotron:
Ook alle andere isotopen van astaat zijn instabiel. Slechts enkele isotopen hebben een halfwaardetijd van meer dan een uur:
- 207At, 1,8 uur;
- 208At, 1,63 uur;
- 209At, 5,4 uur;
- 210At, 8,3 uur;
- 211At, 7.21 uur.