Het zilverwitte, gemakkelijk vervormbare lanthaan is een van de meest reactieve zeldzame aardmetalen. Het oxideert gemakkelijk in lucht en wordt ook door water aangetast. De reeks elementen vanaf lanthaan tot en met lutetium (element 71) wordt de lanthaniden genoemd. Het wordt onder andere gebruikt in de anodes van nikkel-metaal hydride batterijen; in een hybride-auto is al gauw meer dan tien kilo lanthaan verwerkt.
Symbool
La
Protonen/elektronen
Groep
Isotopen
139 La
Periode
6
Elektronenconfiguratie
[Xe] 6s2 4f1
Blok
d
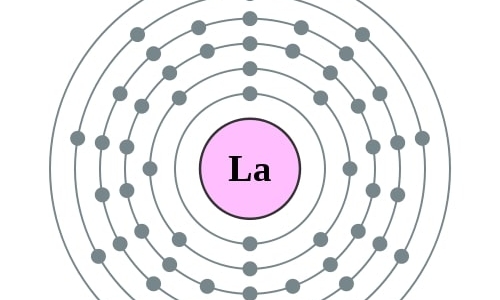
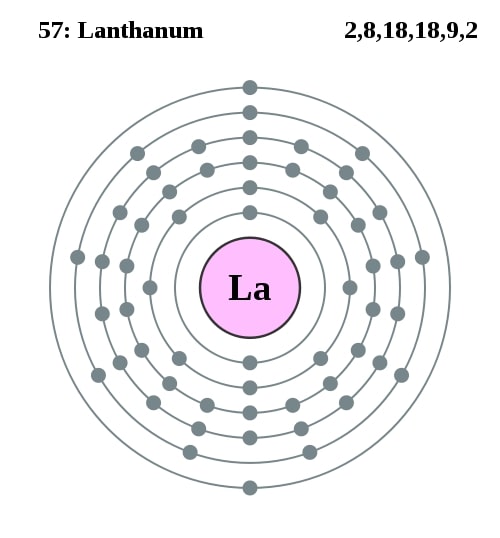
Elektronencofiguratie Bohr
2,8,18,18,9,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,1 (Pauling)
Dichtheid
6150 kg m-3
Atoomstraal
188 10-12m
Smeltpunt
920 oC (1193 K)
Relatieve atoommassa
138.91
Kookpunt
3455 oC (3728 K)
Soortelijke warmte
190 J kg-1K-1
Warmtegeleidingscoëfficiënt
13,5 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Anode metaalhydride batterijen
De meest gebruikte batterijen in hybride auto’s zijn van het nikkel-metaal hydride type. Dat metaal is doorgaans lanthaan, het is te vinden in de anode. Een auto als de Toyota Prius heeft al gauw meer dan tien kilo lanthaan aan boord.

Vuursteentjes
De vuur ‘steentjes’ in wegwerpaanstekers en klassieke benzineaanstekers (Zippo’s) zijn gemaakt van mischmetaal. Dat is een legering van zeldzame aardmetalen met pyrofore eigenschappen. Bij het draaien van het aanstekerwieltje komen zeer kleine deeltjes van het mischmetaal los, die spontaan verbranden. Daardoor ontbrandt het gas of de benzinedamp uit het aanstekerreservoir.
De samenstelling van mischmetaal hangt af van de mineralen die bij de productie voorhanden zijn. Bij benadering bevat mischmetaal 45-60% cerium, 15-30% lanthaan, 10-20% neodymium, 4-6% praseodymium, 1-2% samarium en 0,5-1% yttrium.

Waterstofopslag
Een aantal lanthaanlegeringen kan veel waterstofgas opnemen. LaNi5, een schuimachtige legering van lanthaan en nikkel, zelfs ongeveer vierhonderd maal het eigen volume. De opgenomen waterstof kan ook weer gemakkelijk worden onttrokken. Deze legering is daardoor geschikt als medium voor waterstofopslag.
Batterij-elektrode
De toevoeging van lanthaan aan het metaal voor de elektroden van batterijen verhoogt de hardheid en de corrosie bestendigheid.
Katalysator uitlaatgas
LaPbMnO3 is een goede katalysator voor de omzetting van CO in CO2 en van NOx in N2. Deze verbinding, aangebracht op lanthaanoxide, is een goedkoop alternatief voor platina en palladium in autokatalysatoren.

(Camera)lens
In glas zorgt lanthaanoxide (La2O3) of lanthaancarbonaat (La2(CO3)3) voor een verhoging van de brekingsindex en vermindering van de aberratie (vervaging). Bovendien verhoogt het de chemische weerstand van het glas en de doorlaatbaarheid voor ultraviolet licht. Het glas is daardoor zeer geschikt voor lenzen van camera’s en andere optische apparatuur.
Remmer aderverkalking
Lanthaanchloride, LaCl3, wordt gebruikt om aderverkalking (arteriosclerose) te remmen.
Meer toepassingen
Als element en in legeringen
- keramiek (LaNi5)
- metallurgie
- permanente magneten (LaCo5 en La2Co17)
In verbindingen
| elektrode voor brandstofcel | La2O3 |
| elektrode voor elektronenmicroscoop | LaB6 |
| elektrodemateriaal | LaCrO3, LaCoO3 |
| keramiek voor ovens met zeer hoog temperatuurbereik | LaCrO3 |
| kristal voor lasers | 3La2O3.3Fe2O3 |
| lampen voor de filmindustrie | LaB6 |
| Fosfaatverwijdering bij nierdialyse | Lanthaancarbonaat |
| supergeleiding | La2-xSrxCuO4, LaBa2Cu3O7 |
Naam & ontdekking
Naam
De naam lanthaan is afgeleid van het Griekse woord lanthanein voor verborgen zijn. Het element was in eerste instantie verborgen in ceriumoxide: het allereerste geïsoleerde ceriumoxide bleek bij nader onderzoek een mengsel van oxiden te zijn, waaronder lanthaanoxide.

Ontdekking
De Zweedse chemicus Carl Gustaf Mosander (foto) isoleerde het eerste lanthaanoxide in 1839 uit ceriumoxide. In 1923 werd voor het eerst redelijk zuiver metallisch lanthaan bereid door elektrolyse van gesmolten lanthaanhalogeniden.
Voorkomen
Voorkomen
Het aandeel van lanthaan in de aardkorst bedraagt 3,9.10-3 % (op basis van gewicht). Daarmee staat het op plaats 28 in de ranglijst van meest voorkomende elementen.

De belangrijkste lanthaanhoudende mineralen zijn:
| bastnaesiet-(Ce) | (Ce,La)CO3F |
| bastnaesiet-(Y) | (Y,La)CO3F |
| fergusoniet-(Ce) | (Ce,La,Nd)NbO4 |
| gadoliniet-(Ce) (foto) | (Ce,La,Nd,Y)2Fe,+2Be2Si2O10 |
| lanthaniet-(Ce) | (Ce,La,Nd)2(CO3)3.8H2O |
| lanthaniet-(La) | (La,Ce)2(CO3)3.8H2O |
| lanthaniet-(Ni) | (Nd,La)2(CO3)3.8H2O |
| monaziet-(Ce) | (Ce,La,Nd,Th)PO4 |
| monaziet-(La) | (La,Ce,Nd)PO4 |
| monaziet-(Nd) | (Nd,La,Ce)PO4 |
| samarskiet-(Y) | (Y,Ce,U,Fe+2)3(Nb,Ta,Ti)5O16 |
Winning
De belangrijkste wingebieden liggen in Australië, China, Mongolië, India, Brazilië, de Verenigde Staten van Amerika, Maleisië, Rusland, Tanzania, Burundi, Madagaskar, Noorwegen en Zweden.
Bereiding
Bereiding
Vroeger
Lanthaan behoort (vanzelfsprekend) tot de lanthaniden en de zeldzame aarden. Oorspronkelijk werden deze gescheiden op grond van (uiterst kleine) verschillen in oplosbaarheid van (hydr)oxiden in loog of van die van hun zouten, voornamelijk de oxalaten en sulfaten (met name de oplosbaarheid van Ln2(SO4)3.Na2SO4.xH2O, waarin Ln één van de zeldzame aardmetalen voorstelt). De oplosbaarheid neemt licht toe naarmate de atoommassa van het lanthanide toeneemt. De verschillen zijn zo klein dat vele malen herkristalliseren (1.000 x was geen uitzondering) noodzakelijk was voor een redelijke scheiding.
Zuiver lanthaan werd bereid door reductie van het chloride of fluoride met natrium of calcium.

Tegenwoordig
Pas toen moderne scheidingsmethoden als vloeistof extractie en ionenwisseling werden ontwikkeld (ca. 1950), werd het mogelijk de zouten van de zeldzame aarden in redelijke hoeveelheden te scheiden. Hierbij wordt dikwijls gebruik gemaakt van een waterige oplossing, die wordt geëxtraheerd met tri-n-butylfosfaat. Deze bewerking kan als continuproces worden uitgevoerd.
Om de lanthaniden te verkrijgen wordt monaziet behandeld met geconcentreerd zwavelzuur (bij 200° C), waarbij oplossingen ontstaan van de sulfaten van lanthaan, thorium en aanwezige lanthaniden. Na toevoegen van ammonia slaat eerst het thoriumzout neer. Na toevoegen van natriumsulfaat slaan vervolgens de zouten van de lichtere lanthaniden neer, die na scheiding verder worden gezuiverd.
Vrij zuiver (99 %) lanthaan wordt bereid door reductie van fluoride met calcium of door elektrolyse van gesmolten lanthaanfluoride of -chloride.