Wolfraam heeft het hoogste smeltpunt van alle elementen. Het wordt daarom veel toegepast onder zware thermische belasting, bijvoorbeeld in laselektrodes en gloeidraden. In het Engelse taalgebied heet dit element tungsten.
Symbool
W
Protonen/elektronen
Groep
Isotopen
180W, 182W, 183W, 184W, 186W
Periode
6
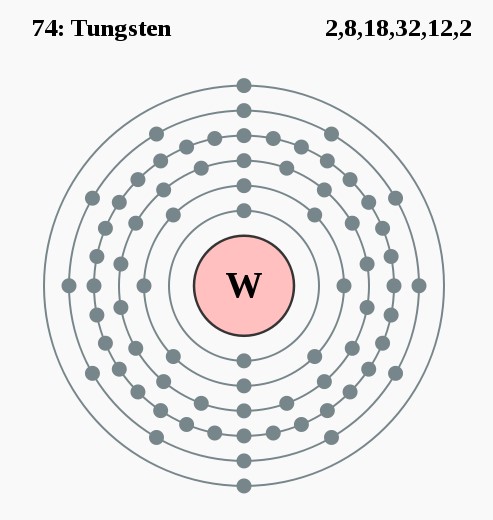
Elektronenconfiguratie
[Xe] 6s2 4f14 5d4
Blok
d
Elektronencofiguratie Bohr
2,8,18,32,12,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,4 (Pauling)
Dichtheid
19300 kg m-3
Atoomstraal
137 . 10-12 m
Smeltpunt
3414 oC (3687 K)
Relatieve atoommassa
183.85
Kookpunt
5555 oC (5828 K)
Soortelijke warmte
135 J kg-1K-1
Warmtegeleidingscoëfficiënt
173 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Laselektrode
Een veelgebruikte manier van lassen staat bekend als TIG-lassen, met TIG als afkorting voor Tungsten-Inert-Gas. Dat is elektrisch lassen met een wolfraam laselektrode, waarbij een constante stroom inert gas (meestal argon) het lasproces vrijwaart van verstorende stoffen zoals zuurstof en stikstof. Dit proces wordt vooral gebruikt voor aluminium en roestvrij staal, maar is ook te gebruiken voor titaan, magnesium. koper en vrijwel alle andere metalen (met uitzondering van zink). Het grote voordeel van de wolfraam elektrode is de enorm goede temperatuurbestendigheid.

Pantser, granaat, kogel
Toegevoegd aan staal (ca. 7 – 22 %) zorgt wolfraam voor een flinke verbetering van de hardheid en hittebestendigheid. Ook als de legering gloeiend heet is, blijft de hardheid behouden, terwijl gewoon staal al boven 200 ºC zacht en slap wordt. De legering is geschikt voor pantserstaal, kogels en granaten.
Gloeidraad lamp
Omdat wolfraam het hoogste smeltpunt heeft van alle metalen is het uitermate geschikt als gloeidraad, onder andere in (halogeen) gloeilampen. Dat geldt ook voor legeringen met wolfraam. Een tweede voordeel van wolfraam is dat het vrijwel dezelfde uitzettingscoëfficiënt heeft als (boorsilicaat)glas.

Een wolfraamdraad van 100 µm doorsnede, opgerold in een dubbele spiraal, in een lamp gevuld met argon of krypton geeft een intens wit licht bij 2.800 – 3.000 ºC. De lamp heeft een levensduur van ongeveer duizend uur. Wordt een halogeen toegevoegd (zie 53 – Jood), dan is de lichtopbrengst nog groter en bedraagt de levensduur zo’n vijfduizend uur.
Straalpijp raket
Bijzonder hittebestendige legeringen van wolfraam met tantaal, hafnium, niobium en/of zirkonium worden gebruikt voor de straalpijpen van raketten en straalmotoren, en voor ionenmotoren.
Snij-, boorgereedschap
Wolfraamcarbide (WC en W2C) is een geschikt materiaal voor snij- en boorgereedschap dat gebruikt wordt bij zeer hoge belasting of met zeer hoge snelheden. Denk bijvoorbeeld aan de boren van tandartsen. Deze stof wordt onder andere onder de naam Widia op de markt gebracht. De naam is afkomstig van het Duitse ‘Wie Diamant’: net als diamant. Ook legeringen van wolfraam met tantaal, nikkel en/of molybdeen zijn in snij-, boor-, slijp- en andere gereedschappen te vinden.

Geneeskunde, bestraling bloedvaten
Bij ongeveer een derde van de patiënten die een dotterbehandeling heeft ondergaan, treedt na enige tijd opnieuw een vernauwing op (restonosis). Om dit tegen te gaan wordt het bloedvat bestraald met bètastralen. Dit gebeurt men een katheter met daarop een 4 cm lange en ca. 0,5 mm dikke spiraal met 188W / 188Re isotopen (bètastralers).
Meer toepassingen
Als element en in legeringen
- Contactpunten in motoren
- Detector in de gaschromatograaf
- Elektrische contacten en schakelingen
- Hitteschild bij ruimtevaartuigen (met V en/of Mo)
- Kernreactortechnologie, o.a. containers voor splijtstof voor kernreactoren
- Matrijzen, walsen
- Metaal met grote treksterkte bij temperaturen boven de 1.650°C
- Ovens
- Röntgenapparatuur, röntgenplaatjes (W,Re)
In verbindingen
| Elektrodemateriaal in brandstofcellen | WC | |||
| Halogeenlampen | WI6 | |||
| Katalysator in de petrochemie | WS2, WO3, W18O49, W20O58 | |||
| Katalytische verwijdering van NOx uit rookgas (denox) | WO3 | |||
| Ontzwaveling in de petrochemie | Ammoniummetawolframaat | |||
| Pigmenten | Wolframaten (NaxWO3; voor x=1 geel, voor x = 0,6 rood en voor x = 0,3 blauw.) | |||
| Röntgenfluorescentiestof | Wolfraamzuur | |||
| Smeer- en slijpmiddel voor boorinstallaties | WC | |||
| Zonnecellen | WO3 |
Naam & ontdekking
Naam
De naam wolfram is afgeleid van Wolf Rahm, het Duitse woord voor wolfsschuim. De Saksische wetenschapper Georg Paver (of Bauer), beter bekend onder zijn wetenschappelijke naam Georgius Agricola (foto) duidde daar het schuim mee aan dat bij de bereiding van het metaal tin funest was voor de opbrengst. Het ’tinverslindende’ schuim bleek het gevolg te zijn van de aanwezigheid van wolfraammineralen. Agricola gebruikte overigens de Latijnse term spuma lupi. Hij verwierf grote internationale bekendheid met zijn in 1556 gepubliceerde metaalkundige ‘standaardwerk’ De re metallica.

De naam zou ook (zijdelings) betrekking kunnen hebben op Peter Woulfe, de Ierse chemicus/mineraloog die in 1779 als eerste veronderstelde dat het mineraal dat we nu kennen als wolframiet een tot dan toe onbekend, nieuw element zou bevatten.
De in het Engelse en Franse taalgebied gehanteerde naam, tungsten respectievelijk tungstène, is afgeleid van het Zweedse tung sten voor zware steen. De Zweedse mineraloog/chemicus Axel Fredrik Cronstedt duidde daarmee het wolfraamhoudende mineraal aan dat tegenwoordig scheeliet heet. Dat heeft inderdaad een hoge dichtheid.

Ontdekking
De Spaanse chemici José and Fausto Elhuyar (foto) gelden als de ontdekkers van wolfraam. Ze wisten het element in 1783 te isoleren uit het oxide, via reductie met koolstof. Overigens had de Duits/Zweedse chemicus Carl Wilhelm Scheele dat oxide twee jaar eerder al verkregen uit het tungsten mineraal. Bovendien had hij met zijn Zweedse collega Torbern Bergman beschreven dat er een nieuw element uit te winnen zou zijn. Maar de Spaanse broers gingen dus met die eer strijken.
Voorkomen
Voorkomen
Wolfraam is nummer 57 op de lijst van meest voorkomende elementen. Het aandeel in de aardkorst bedraagt 1,25.10-4 % op basis van gewicht.

De belangrijkste wolfraam houdende mineralen zijn
| Anthoïniet | WAl(O,OH)3 | |||
| Ferberiet (foto) | FeWO4 | |||
| Hübneriet | MnWO4 | |||
| Raspiet of stolziet | PbWO4 | |||
| Russeliet | Bi2WO6 | |||
| Sanmartiniet | (Zn,Fe+2)WO4 | |||
| Scheeliet | CaWO4 | |||
| Tungsteniet | WS2 | |||
| Tungstiet of wolfraamoker | WO3.H2O | |||
| Wolframiet | (Fe+2 ,Mn+2)WO4 |
Winning
De belangrijkste wingebieden liggen in China, Canada, de Verenigde Staten van Amerika, Rusland, Kazakstan, Australië, Korea, Oeganda, Burma, Thailand, Groot-Brittannië, Bolivia, Peru en Portugal. Ook elders in Europa zijn nog (kleine) reserves: Frankrijk, Oostenrijk, Slovenië, Spanje, Tsjechië. De EU heeft met de Critical Raw Materials Act in 2022 het element wolfraam op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
De Spaanse chemiebroers Elhuyar reduceerden in 1783 wolframiet met koolstof en verkregen zo het allereerste wolfraam.

Tegenwoordig
Wolfraam houdende ertsen worden (na de nodige voorbewerkingen) gesmolten met natrium- of kaliumhydroxide, waarbij natriumwolframaat ontstaat. Dit wordt omgezet in ammoniumwolframaat, dat bij verhitting tot wolfraamoxide (WO3) leidt. Reductie met waterstof of koolstof levert vervolgens het – poedervormige – metaal. Door persen/sinteren in een waterstofatmosfeer en walsen verkrijgt men het metaal in draad- of plaatvorm.