Het kleurloze, geurloze argon komt slechts in kleine hoeveelheden in de atmosfeer voor. Het reageert eigenlijk nergens mee – het behoort dan ook tot de edelgassen. Dat Finse wetenschappers in het jaar 2000 toonden aan dat het bij 265 graden onder nul wel met waterstoffluoride reageert doet daar maar weinig aan af. Argon wordt veel gebruikt om een chemisch inerte omgeving te creëren. Bijvoorbeeld om onderzoek te doen aan materialen die in lucht instabiel zijn. Of om lasverbindingen van hoge kwaliteit te kunnen realiseren.
Symbool
Ar
Protonen/elektronen
Groep
Isotopen
36Ar, 38Ar, 40Ar
Periode
3
Elektronenconfiguratie
[Ne] 3s2 3p6
Blok
p
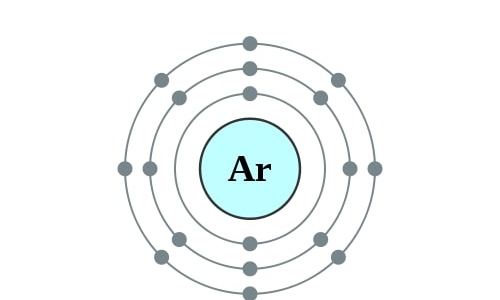
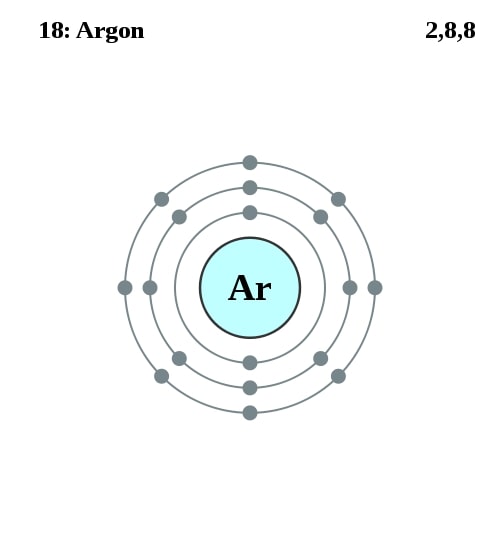
Elektronencofiguratie Bohr
2,8,8
Bij kamertemperatuur
gas
Elektronegativiteit
2,0 (Pauling)
Dichtheid
1.66 kg m-3
Atoomstraal
Smeltpunt
-189 oC (84 K)
Relatieve atoommassa
39.948
Kookpunt
-186 oC (87 K)
Soortelijke warmte
520 J kg-1K-1
Warmtegeleidingscoëfficiënt
0.016 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Gloeilampvulling
Vanwege de zeer geringe warmtecapaciteit en de grote inertheid is argon – meestal gemengd met 10 – 20 % stikstof – geschikt voor de vulling van gloeilampen. Reguliere gloeilampen zijn nauwelijks meer te koop, maar ook de energiezuiniger halogeenlampen zijn in essentie gloeilampen. Het argon gaat de verdamping van de wolfraam gloeidraad tegen. Het warmtegeleidingsvermogen is kleiner dan van stikstof, waardoor hogere gloeitemperaturen mogelijk zijn. Hierdoor is het uitgezonden licht witter dan bij gebruik van stikstof.
Gasontladingsbuis
Je vind argon ook in gasontladingsbuizen. Argon is dan meestal gemengd met andere edelgassen. De samenstelling van het gasmengsel bepaalt de kleur van het uitgezonden licht (zie ook 10 – Neon). De TL-buis (Tube Luminescent) is ook een voorbeeld van een gasontladingslamp. Daarbij bepaalt de fluorescerende stof aan de binnenzijde van de buis de kleur van het licht.

Geigerteller
Met de Geigerteller (voluit Geiger-Müller-telbuis) is sterkte van ioniserende straling (radioactieve- of röntgenstraling) te meten. Het in essentie een lage druk gasontladingsbuis, gevuld met argon (of een ander edelgas), eventueel in een mengsel met methaan. De omstandigheden zijn zodanig dat er normaal gesproken net geen ontlading optreedt. Als straling de buis binnenkomt zal er ionisatie plaatsvinden en volgt een ontlading. Het gevolg is een stroomstoot, die op verschillende manieren is te registreren. Bijvoorbeeld met een meter, een teller of een luidspreker.
Laser
Argon is – vaak samen met neon – in allerlei lasers te vinden. De meeste argonlasers geven groen, blauw of ultraviolet licht. Het toevoegen van fluor of waterstoffluoride resulteert in de vorming van ArF. Dit gas geeft diep ultraviolet laserlicht met een golflengte van 193 nm. Deze lasers zijn van belang voor de fabricage van computerchips en andere micro-elektronica. Andere argonlasers worden vanwege hun fotothermisch effect gebruikt voor medische toepassingen zoals oogchirurgie, dotteren (schoonmaken van deels dichtgeslibte bloedvaten) en het verwijderen van tatoeages.
Beschermgas lassen
Bij het lassen van metalen in lucht ontstaan gemakkelijk metaaloxiden en -nitriden die de kwaliteit van de las nadelig beïnvloeden. Daarom gebruikt men argon als beschermgas bij het lassen van (onder andere) koper, aluminium, titaan, magnesium, tantaal, wolfraam en (roestvrij) staal. Ook bij de bereiding van deze metalen en bij bewerkingen waarbij deze metalen in gesmolten toestand komen, kan argon als beschermgas dienen.

Als bij deze vorm van lassen een wolfraam-elektrode wordt gebruikt, spreken we van TIG-lassen (Tungsten-Inert-Gas); als het te lassen metaal zelf als elektrode dient, spreekt men van MIG-lassen (Metal-Inert-Gas).
Cryotherapie (geneeskunde)
Bij een aantal vormen van kanker, o.a. nier- en prostaatkanker, bevriest men de tumorcellen met vloeibaar argon, dat door een holle naald wordt geperst. De punt van de naald heeft een daardoor een temperatuur van ongeveer -40 oC. De behandeling vindt doorgaans plaats via een minimaal invasieve ‘kijk’ operatie, waardoor een ‘echte’ operatie niet nodig is. Als de koude naald in de tumor wordt geprikt bevriest het vocht in de cel, waardoor de tumor uitdroogt en verschrompelt.
Meer toepassingen
- Controle van gasleidingen (41Ar)
- Ouderdomsbepaling van mineralen (39Ar,40Ar of K/Ar-methode)
- Productie van zeer zuiver silicium, o.a. voor chips in de halfgeleiderindustrie (beschermgas)
Naam & ontdekking
Naam
De naam argon komt van het Griekse woord argon, dat niet werkzaam betekent. Vanzelfsprekend ligt de inertheid van het gas hieraan ten grondslag.
Ontdekking
Argon werd ontdekt in 1894 – ongeveer een eeuw nadat Henry Cavendish het vermoeden van het bestaan van ‘restgassen’ in lucht had uitgesproken. De Britten William Ramsay en John Strutt (Lord Rayleigh) (foto) ontdekten het als eersten in lucht waaruit zuurstof, stikstof en koolstofdioxide waren verwijderd.
Ze ontdekten dat atmosferische stikstof een iets andere dichtheid had dan stikstof bereid uit ammoniak. Uit atmosferische stikstof verwijderden ze daarom de stikstof met magnesium. Bij hoge temperatuur wordt het stikstof gebonden tot magnesiumnitride (Mg3N2). Het gas dat overbleef bleek inert en kreeg daarom de naam argon.
Later bleek dat dit restant van atmosferische stikstof, het ‘ruwe argon’, nog meer edelgassen bevatte. Scheiding van deze gassen vond enige jaren later plaats via de inmiddels ontwikkelde techniek van destillatie van vloeibare lucht.
Omdat er geen plaats was om het ontdekte argon in het periodiek systeem onder te brengen, stelde Ramsay voor een geheel nieuwe groep aan het periodiek systeem toe te voegen. Hij kreeg onder meer hiervoor de Nobelprijs voor scheikunde in 1904. Lord Rayleigh kreeg in hetzelfde jaar de Nobelprijs voor natuurkunde.
De inertheid van de edelgassen was één van de belangrijkste ondersteunende feiten voor de theorie die bindingen tussen atomen en de vorming van ionen verklaart vanuit een stabiele octetomringing.
Voorkomen
Voorkomen
Argon is nauwelijks aanwezig in de aardkorst. Het heeft daar een aandeel van 3,5.10-4 % op gewichtsbasis en staat daarmee op plaats 43e in de lijst van meest voorkomende elementen. In de dampkring is het met een aandeel 0,94% het meest voorkomende element na zuurstof en stikstof.
Argon is ook te vinden in bronwater dat op grotere diepte is opgesloten.
Ook op andere planeten (onder andere op Mars) is argon aangetoond.
Winning
Argon wordt gewonnen uit de atmosfeer (luchtscheiding).