Zuurstof, een kleurloos en reukloos diatomair gas, speelt de hoofdrol in ademhaling en verbranding. Kenmerk van die processen is oxidatie, waarbij stoffen een verbinding aangaan met zuurstof. In breder chemisch perspectief is voor oxidatie trouwens niet persé zuurstof nodig – alles wat elektronen kan wegnemen heet een oxidator. Zuurstof is na waterstof en helium het meest voorkomende element in het heelal. Op aarde voert het de lijst van elementen aan. Ongeveer een vijfde van onze atmosfeer, bijna de helft van de aardkorst en ongeveer twee derde van ons lichaam bestaat uit zuurstof. Vloeibaar en vast zuurstof heeft een lichtblauwe kleur.
Symbool
O
Protonen/elektronen
Groep
Isotopen
16O, 17O, 18O
Periode
2
Elektronenconfiguratie
[He] 2s2 2p4
Blok
p
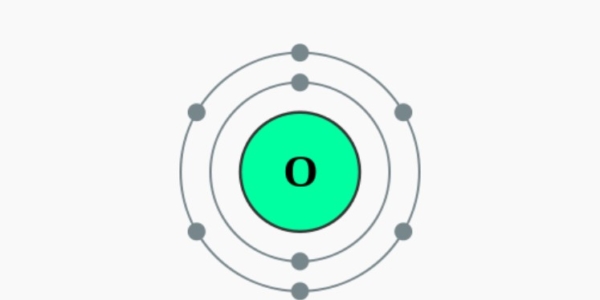
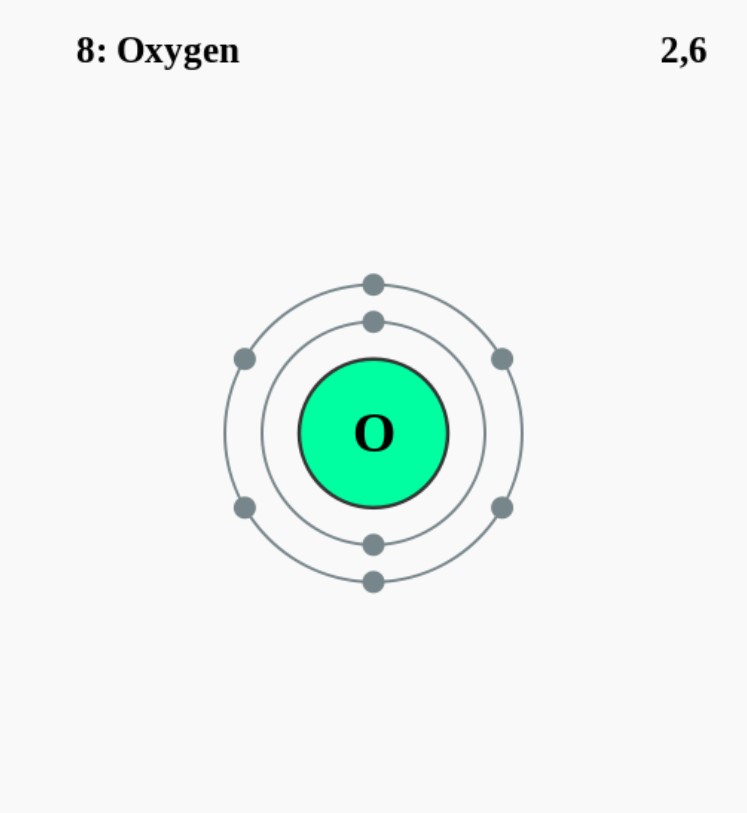
Elektronencofiguratie Bohr
2,6
Bij kamertemperatuur
gas
Elektronegativiteit
3,5 (Pauling)
Dichtheid
1.33 kg m-3 (O2)
Atoomstraal
66 . 10-12 m
Smeltpunt
-219 oC (54 K)
Relatieve atoommassa
15.9994
Kookpunt
-183 oC (90 K)
Soortelijke warmte
920 J kg-1 K-1
Warmtegeleidingscoëfficiënt
0.025 W m-1 K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Verbrandingsproces
Voor het verbranden van alle soorten fossiele brandstoffen is zuurstof nodig. Neem bijvoorbeeld de verbranding van aardgas:
De benodigde zuurstof is in de atmosfeer aanwezig. Ook de verbranding van benzine, diesel of kerosine in motoren verloopt dankzij atmosferische zuurstof. Aangezien de atmosfeer ook stikstof bevat, in een gunstige verhouding met zuurstof (80/20), zijn verbrandingsprocessen op aarde goed beheersbaar en treedt zelden spontane verbranding op.

Als er onvoldoende zuurstof aanwezig is om de gewenste verbrandingsreactie op gang te houden, moet het op andere wijze beschikbaar zijn. Daarom wordt in raketmotoren vloeibare zuurstof benut. Snijbranders (foto) en lastoortsen verbranden ethyn (C2H2 , acetyleen) met zuivere zuurstof. Dat leidt tot hoge temperaturen, tot wel 3200 °C, genoeg voor het smelten van staal en andere metalen.
Ademhaling en beademing
Bij iedere ademteug nemen (volwassen) mensen zo’n halve liter lucht in, met daarin ruim een deciliter zuurstof. In rust gebeurt dat per minuut twaalf tot vijftien keer. Van de ingeademde zuurstof wordt slechts een deel door de longen opgenomen, in totaal drie tot vier deciliter per minuut. Per dag verbruikt een mens zodoende vier- tot zeshonderd liter zuivere zuurstof. Het lichaam benut de zuurstof om energie vrij te maken uit moleculen zoals glucose en andere suikers. Daarbij ontstaat koolstofdioxide en water, dat wordt uitgeademd.

Zuurstof wordt toegediend bij mensen die vanwege medische omstandigheden problemen hebben met ademhalen. Ook mensen die zich in lucht- of zuurstofarme omstandigheden begeven, zoals duikers en bergbeklimmers, gebruiken zuurstof.
Staalbereiding
Meer dan de helft van alle geproduceerde zuurstof dient voor de bereiding van staal. Nadat in een hoogoven ijzererts tot vloeibaar ijzer is verwerkt, injecteert men onder hoge druk zuurstof in het gesmolten ijzer. Dit vindt plaats in zogenaamde ‘convertoren’. Hierbij worden ongewenste elementen uit het ijzer (met name zwavel en koolstof) omgezet in vluchtige oxides (SO2 and CO2).
Chemische processen
De chemische industrie is ook een grootverbruiker van zuurstof. Het dient onder andere voor de reactie van etheen tot etheenoxide. Dit is de grondstof voor een heel scala aan producten, van kunststoffen tot antivriesmiddel.

Meer toepassingen
Als element
- Bereiding van ozon
- Productie van salpeterzuur, zwavelzuur
- Bereiding van waterstofperoxide
- Synthese van organische producten
In verbindingen
| Antisepticum (mondspoeling) | H2O2 |
| Bleekmiddel voor papier, hout | Na2O2 |
| Bleekmiddel in tandpasta | MgO2< |
| Bleken van textiel, papier, hout, olie, vet en haar | H2O2 |
| Desinfectiemiddel | O3, H2O2 |
| Drogen van gassen | P2O5 |
| Kristalglas | PbO |
| Neutraliseren van maagzuur | Al2O3 |
| Polijsten van staal | SnO |
| Porselein | PbO |
| Radiodiagnostiek, als tracer voor onderzoek naar doorbloeding | 15O |
| Schuurpoeder | Al2O3 |
| Stijven van textiel borax | Na2B4O5(OH)4.8H2O |
| Verwijderen van zwaveldioxide uit rook | H2O2 |
| Vuurvaste steen, aardewerk, porselein | Al2O3 |
| Vuurvaste tegels | ZrO2 |
| Zuivering van water | H2O2 |
Naam & ontdekking
Naam
De Latijnse naam oxygenium is afkomstig van de Griekse woorden oxys en geinomai, dat zuurvormer betekent. De Franse chemicus Antoine Lavoisier stelde die naam in 1777 voor omdat het in alle (toen bekende) zuren voorkwam. De veronderstelling was dat zuurstof de zure eigenschappen van de zuren veroorzaakte. De Nederlandse term zuurstof is een vrijwel letterlijke vertaling.
De naam ozon is afkomstig van het Griekse ozein, wat geuren of rieken betekent.
Ontdekking
De ontdekking van zuurstof wordt toegeschreven aan de Duits-Zweedse chemicus Carl Wilhelm Scheele (foto) en de Engelsman Joseph Priestley. Zij publiceerden (onafhankelijk van elkaar) concrete beschrijvingen van zuurstof als onderdeel van lucht en slaagden er bovendien in het element vrij te maken uit een zuurstofhoudende verbinding.

Voorkomen
Voorkomen
Zuurstof is het meest voorkomende element op aarde. Het water in de oceanen bevat 85,8% zuurstof en het menselijk lichaam bestaat voor ruim 60% uit zuurstof (berekend op basis van gewicht). De elementaire vorm van zuurstof (O2) komt vooral in de atmosfeer voor, met een aandeel van 21%. Daar is ook de bijzondere zuurstofvorm ozon (O3) aan te treffen.

Bijna de helft (46,1%) van de aardkost bestaat uit zuurstof. Het zit in gesteenten en mineralen in verbinding met een breed scala aan andere elementen. Bijvoorbeeld:
- Agaat SiO2
- Amethist (foto) SiO2
- Anataas TiO2
- Cassiteriet SnO2
- Chromiet FeCr2O4
- Corundum Al2O3
- Cupriet Cu2O
- Hematiet Fe2O3
- Kwarts SiO2
- Magnetiet Fe + 2Fe + 32O4
- Opaal SiO2
- Spinel MgAl2O4
Ook in silicaten, carbonaten en sulfaten is zuurstof aanwezig. De meest voorkomende verbinding is siliciumdioxide (SiO2, silica, het hoofdbestanddeel van zand).
Winning
De productie van zuivere zuurstof vindt plaats in ‘luchtfabrieken’, waar men de in lucht aanwezige gassen isoleert.
Bereiding
Bereiding
Vroeger
Zuurstof werd vroeger bereid door verhitting van zuurstofhoudende verbindingen, zoals kaliumnitraat, kwik(II)oxide of kaliumchloraat, met bruinsteen als katalysator:
Bijv.:
Tegenwoordig
Industriële productie van zuurstof vindt tegenwoordig vooral plaats in ‘luchtfabrieken’ die lucht via gefractioneerde destillatie scheiden in de samenstellende gassen. Zuurstof is het belangrijkste product, met stikstof als ‘bijvangst’ (hoewel dat in veel grotere hoeveelheden wordt geproduceerd). Verder produceren deze fabrieken edelgassen zoals argon, neon en krypton.

In de natuur produceren planten op grote schaal zuurstof via fotosynthese. Met koolstofdioxide (afkomstig uit de lucht) en water als grondfstoffen maken ze – met behulp van chlorofyl en zonlicht – koolhydraten en zuurstof.
Bij dit proces wordt in feite zuurstof vrijgemaakt uit water:
en vervolgens