In zijn elementaire vorm is stikstof een kleurloos, geurloos en inert gas. Dat is maar goed ook, want ongeveer 78% van de atmosfeer bestaat uit stikstof. Het komt voor als diatomaire moleculen, N2. De binding tussen de twee stikstofatomen is relatief sterk. Het vormt wel vrij gemakkelijk componenten (nitriden) met magnesium, lithium en calcium. Stikstofhoudende verbindingen zijn essentiële componenten in voedingsmiddelen, kunstmeststoffen en explosieven. Stikstof uit de lucht is vast te leggen met behulp van het Haber-Bosch proces voor de productie van ammoniak. Het is één van de eerste industrieel toegepaste chemische processen en ook vandaag de dag nog van groot belang.
Symbool
N
Protonen/elektronen
Groep
Isotopen
14N, 15N
Periode
2
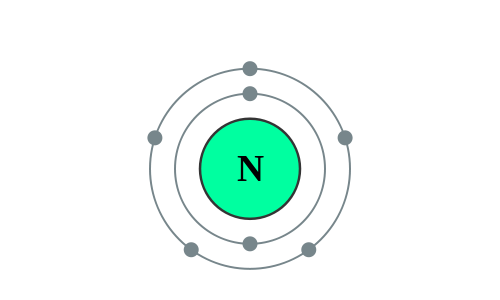
Elektronenconfiguratie
[He] 2s2 2p3
Blok
p
Elektronencofiguratie Bohr
2,5
Bij kamertemperatuur
gas
Elektronegativiteit
3,1 (Pauling)
Dichtheid
1.17 kg m-3 (N2)
Atoomstraal
70 . 10-12 m
Smeltpunt
-210 oC (63 K)
Relatieve atoommassa
14.0067
Kookpunt
-196 oC (77 K)
Soortelijke warmte
1040 J kg-1K-1
Warmtegeleidingscoëfficiënt
0.024 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Koel- en koudemiddel
Vloeibaar stikstof heeft onder atmosferische omstandigheden een temperatuur van -195,8 °C (de kooktemperatuur). Dat maakt het tot een geschikt een veelgebruikt koelmiddel.
Bloed, sperma, eicellen, stukjes weefsel en ander biologisch materiaal voor medisch wetenschappelijk onderzoek wordt opgeslagen in stikstofgekoelde containers. Vloeibare stikstof wordt ook gebruikt om wratten aan te stippen. Hierdoor sterven de cellen af en verschrompelt de wrat.

Bij de zeer lage stikstoftemperatuur is voedsel snel in te vriezen. Conservering bij die lage temperatuur zorgt er bovendien voor dat de eigenschappen veel beter behouden blijven dan bij het conventionele invriezen. In de moleculaire gastronomie is vloeibare stikstof een onmisbaar hulpmiddel bij nieuwe bereidingsmethoden gebaseerd op lage tempraturen in plaats van hoge.
In de recycling van rubber wordt vloeibaar stikstof gebruikt om het rubber breekbaar te maken.
In de werktuigbouw zijn ringen en flenzen stevig op assen te bevestigen door de as af te koelen met vloeibare stikstof. Ze kunnen daarna alleen nog door snijbranden verwijderd worden.
Ammoniak
Ammoniak (NH3) vormt de basis van moderne stikstofmeststoffen. In 1913 vond bij BASF in Ludwigshafen de eerste industriële ammoniakproductie plaats volgens het Haber-Bosch proces. Dit is sindsdien eigenlijk nauwelijks gewijzigd.
De wereldproductie van ammoniak bedraagt nu ongeveer tweehonderd miljoen ton per jaar. Volgens schattingen is ongeveer een derde van de wereldbevolking afhankelijk van landbouwproducten geteeld met kunstmest op basis van Haber-Bosch ammoniak. Overigens heeft ammoniak ook minder positieve toepassingen: het vormt de basis voor de vervaardiging van explosieven.
De Duitse chemicus Fritz Haber kreeg in 1918 de Nobelprijs Chemie voor de ontdekking van de syntheseroute naar ammoniak. Landgenoot Carl Bosch chemisch technoloog, ontwikkelde er industrieel proces voor. Hij kreeg de Nobelprijs in 1931.

Het Haber-Bosch proces verbindt stikstof en waterstof. De stikstof is afkomstig uit de lucht, waterstof wordt verkregen door reactie van aardgas (of andere koolwaterstoffen) met stoom. De omzetting tot ammoniak gebeurt bij een druk van 200.105 Pa en een temperatuur van 425 °C met behulp van een katalysator van zeer fijn verdeeld ijzer.
Deze reactie is een evenwichtsreactie. Bij de gegeven omstandigheden bevat het gasmengsel ongeveer 15 % ammoniak. Het wordt afgescheiden via condensatie, waarna het overblijvende gas opnieuw naar de reactor gaat.
Kunstmest
Stikstof meststoffen zijn belangrijk voor de groei van planten, die stikstof niet rechtstreeks uit de lucht kunnen opnemen. Voor een ton aardappelen is ongeveer 3,2 kg stikstof nodig, voor een ton graan 18 kg.
De N-meststoffen bevatten meestal ammoniumzouten of nitraten. De nitraten zijn voornamelijk van synthetische oorsprong. Ze komen tot stand via de salpeterzuursynthese ontwikkeld door de Duitse chemicus Friedrich Wilhelm Ostwald (1853 – 1932). Dit proces, dat ook nu nog vrijwel ongewijzigd wordt uitgevoerd, oxideert ammoniak bij hoge temperatuur en druk (850 °C, 5.105 Pa) met behulp van platina als katalysator. Ostwald ontving in 1909 voor deze vinding de Nobelprijs.

Enkele voorbeelden van stikstofhoudende kunstmest zijn:
- Ammoniumnitraat, NH4NO3
- Ammoniumsulfaat, (NH4) 2SO4
- Chilisalpeter, NaNO3
- Diammoniumfosfaat, (NH4) 2HPO4
- Kalksalpeter, Ca(NO3) 2
- Monoammoniumfosfaat, NH4H2PO4
- Ureum, CO(NH2) 2
Deze stikstofmeststoffen worden zelden afzonderlijk toegepast. Behalve stikstof zijn ook fosfor, kalium, calcium, zwavel en magnesium van belang voor de plantengroei. Kunstmest bestaat daarom vrijwel altijd uit een mengsel van meststoffen, afhankelijk van de behoefte. Enkele voorbeelden zijn kalkammonsalpeter (een mengsel van ammoniumnitraat en kalk) en magnesammon (een mengsel van ammoniumnitraat en magnesiumoxide).
Springstof
De meeste springstoffen zijn organische verbindingen met een aantal reactieve -ONO2 of -NO2-groepen. Na ontsteking volgt een zeer snelle en heftige reactie waarbij niet alleen veel energie vrijkomt (de reactie is exotherm) maar waarbij ook veel gas ontstaat. In zeer korte tijd ontstaat dus hoge temperatuur en hoge druk: een explosie.
De meest bekende springstoffen zijn:
Dynamiet
Dynamiet is de combinatie van het zeer instabiele glyceryltrinitraat, ook wel nitroglycerine, met een bindmiddel. Puur nitroglycerine ontploft bij de geringste verandering in temperatuur of druk, of door licht stoten. De bekende Zweedse chemicus Alfred Nobel (1833 – 1896) wist het te stabiliseren met kiezelgoer, een poreus gesteente. Tegenwoordig worden andere bindmiddelen gebruikt, meestal gelatineachtige producten.
TNT
Trinitrotolueen (afgekort: TNT) is van zichzelf veel stabieler dan nitroglycerine. Het is één van de meestgebruikte explosieven in militaire toepassingen (bommen, granaten, mijnen) en in industriële toepassingen (zoals mijnbouw). De explosieve kracht van kernwapens wordt uitgedrukt in het equivalent van het aantal ton TNT.
Semtex
Semtex is een kneedbare springstof van een nieuwe generatie. Het is zeer stabiel en dus gemakkelijk te hanteren en te vervoeren. Semtex is alleen met behulp van een ontsteker tot ontploffing te brengen. Het explosief kreeg onder terroristen grote populariteit omdat het lange tijd zeer moeilijk was op te sporen. De Tsjechische producent voegt tegenwoordig een sterk ruikende markeerstof toe.
Semtex is een combinatie van twee springstoffen: RDX (cyclotrimethyleentrinitramine) en pentriet (pentaerythritoltetranitraat). Samengevoegd met een bindmiddel (een polymeer) en een weekmaker vormen die een kneedbare massa.
In Amerika is C4 populair, een aan Semtex verwant explosief met RDX als belangrijkste springstof.

Reduceren uitstoot vrachtauto’s
Om de uitstoot van stikstofoxiden (NOx) door dieselmotoren te reduceren, wordt ureum {CO(NH2)2} aan de uitlaatgassen toegevoegd. Bij het passeren van de katalysator worden de stikstofoxiden omgezet in stikstof en water. Een alternatief voor ureum is het toevoegen van een oplossing van ammoniumformiaat (NH4HCOO).
Meer toepassingen
Als element
- Bereiden, koelen en zuurstofvrij verpakken van levensmiddelen en farmaceutische producten
- Bereiding en verwerking van metalen, bijvoorbeeld staal en aluminium
- Bevriezen van de grond bij het boren van tunnels
- Bewaren van fruit in een atmosfeer met weinig zuurstof
- Bijsturen van de calorische waarde van aardgas
- Brandbestrijding (o.a. in mijnen)
- Drijfgas in spuitbussen
- Verdunnen van zeer brandbare gassen
- Voorkomen van explosies bij de olie- en gaswinning
In verbindingen
| Opblazen airbag | NaN3 |
| Conserveren van vleeswaren | NH4NO3 |
| Conserveren: E250 | NaNO2 |
| Conserveren: E251 | NaNO3 |
| Conserveren: E252 | KNO3 |
| Drijfgas in spuitbus (o.a. voor slagroom) | N2O |
| Anesthesie of narcose | N2O |
| Vaatverwijderaar o.a. bij angina pectoris | Glyceryltrinitraat |
| Halfgeleider en medium vaststoflaser | GaN, InN |
| Kunsthars | Ureum-formaldehyde |
| Kunststoffen | Polyamiden/nylons |
| Leerlooien | Al(NO3) 3 |
| Munitie | Loodazide; PbN6 |
| Slijpschijven | BN |
| Springstof | NaN3 |
| Synthetische diamant | BN |
Naam & ontdekking
Naam
De Latijnse naam voor stikstof is nitrogenium, vandaar het symbool N. Daaraan ten grondslag ligt het Griekse nitron gennan, dat zoveel betekent als vormer van nitron. Met nitron werden de mineralen aangeduid die nitraat (of ook: salpeter) bevatten.
De Schotse natuur- en scheikundige Daniel Rutherford (foto), die als eerste stikstof uit lucht isoleerde, noemde het noxious air. Schadelijke lucht dus, omdat een vlam er in dooft.

De Nederlandse benaming stikstof verwijst naar het feit dat levende organismen in het gas stikken, net zoals de Franse naam azote, voorgesteld door Antoine Laurent Lavoisier. Die is afgeleid van het Griekse azotikos, dat ‘geen leven’ betekent. De Franse benaming is terug te vinden in de benaming azide voor verbindingen met een N3-groep en in het voorvoegsel azo– voor stikstofhoudende verbindingen met de algemene formule R-N=N-R–>.
Ontdekking
Stikstofverbindingen waren al in de Oudheid bekend. Salmiak (ammoniumchloride) is al beschreven in de ‘Historia’ van Herodotos, geschreven in de 5e eeuw voor onze jaartelling.
In 1772 isoleerde Rutherford stikstof uit lucht door eerst de zuurstof te verwijderen (door verbranding met koolstof) en daarna het gevormde koolstofdioxide te binden aan een alkalische oplossing. Rutherford zag stikstof nog niet als element, maar als ‘flogistonrijke lucht’. Pas in 1840, na de ontwikkeling van de verbrandingstheorie van Lavoisier, werd stikstof als een afzonderlijk element beschouwd.
Hoewel Rutherford als ‘ontdekker’ van stikstof geldt, slaagden ook anderen er in dezelfde periode in het element op vergelijkbare manier te isoleren: de Zweedse chemicus Carl Wilhelm Scheele, de Britse natuur- en scheikundige Henry Cavendish en diens landgenoot Joseph Priestley.
Voorkomen
Voorkomen
De aardse atmosfeer bestaat voor het grootste deel uit stikstof: 78,1% op basis van volume. Berekend naar gewicht bedraagt het aandeel van stikstof 75,3%.
In de aardkorst is stikstof goed voor 1,9.10-3 % van het totaal. Het staat 34e op de lijst van meestvoorkomende elementen. Stikstof is te vinden in een groot aantal mineralen, waarvan salpeter (KNO3, foto) en chilisalpeter (NaNO3) de belangrijkste zijn.

Stikstof speelt ook een belangrijke rol in de biosfeer, het deel van de aarde waar leven mogelijk is. Veel organische verbindingen, zoals aminozuren, eiwitten, amiden en polyamiden, nitroverbindingen bevatten stikstof. Ongeveer vier procent van het droge gewicht van planten bestaat uit stikstof, net zoals een kleine drie procent van het menselijk lichaam. Het is na zuurstof, koolstof en waterstof het meest voorkomende element in ons lichaam.
Ook op de schaal van het heelal komt stikstof veel voor. Het is naar schatting het zevende element in voorkomen in het melkwegstelsel en ons zonnestelsel. Alle stikstof is waarschijnlijk ontstaan door de fusie van koolstof en waterstof in supernova’s.
Winning
Tot de ontwikkeling van het Haber-Bosch proces was de wereld voor de nitraatvoorziening (met name voor kunstmest) afhankelijk van mineralen. Een andere belangrijke bron was het ‘guano’: verdroogde vogelmest, afkomstig van Peru (foto) en een aantal eilanden in de Grote Oceaan. De belangrijkste wingebieden voor minerale nitraten (salpeter) zijn Chili, Peru, India, Bolivia, Italië, Spanje en Rusland. Salpeter uit Chili bevat een zeer hoge concentratie nitraten en in de loop der tijd is chilisalpeter synoniem geworden voor nitraatbevattende kunstmest.

Bereiding
Vroeger
De allereerste bereiding van stikstof uit lucht vond plaats door eerst de zuurstof te verwijderen (via verbranding met koolstof) en vervolgens het gevormde koolstofdioxide te binden aan een alkalische oplossing. Wat dan overblijft is zo goed als zuivere stikstof.
Tegenwoordig
Vandaag de dag wordt stikstof voornamelijk bereid via gefractioneerde destillatie van vloeibare lucht. Het is vaak een bijproduct uit ‘luchtfabrieken’ die vooral zuurstof maken voor staalproductie en andere toepassingen.

Zeer zuivere stikstof is op laboratoriumschaal te bereiden door ontleding van natriumazide
of van ammoniumnitriet (een mengsel van natriumnitriet en ammoniumchloride)