Fosfor is één van de bouwstenen van DNA en ook van ATP – het energiemolecuul van levende cellen. De gemiddelde mens heeft ongeveer driekwart kilo fosfor in zijn lichaam. Fosfaten vormen een belangrijk onderdeel van kunstmest en kunnen voor problemen zorgen als ze via uitspoeling in het oppervlaktewater terecht komen. Fosfor kent verschillende verschijningsvormen (allotropen) waarvan witte en rode fosfor de meest bekend zijn. Witte fosfor kan spontaan in de lucht ontbranden en is giftig, de rode variant is stabieler en ongevaarlijk.
Symbool
P
Protonen/elektronen
Groep
Isotopen
31P
Periode
3
Elektronenconfiguratie
[Ne] 3s2 3p3
Blok
p
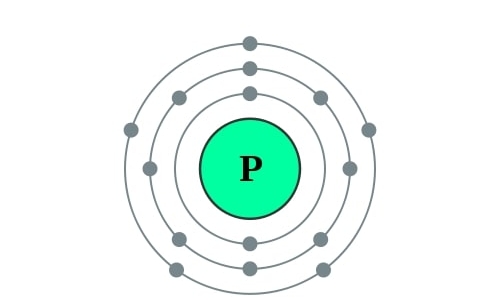
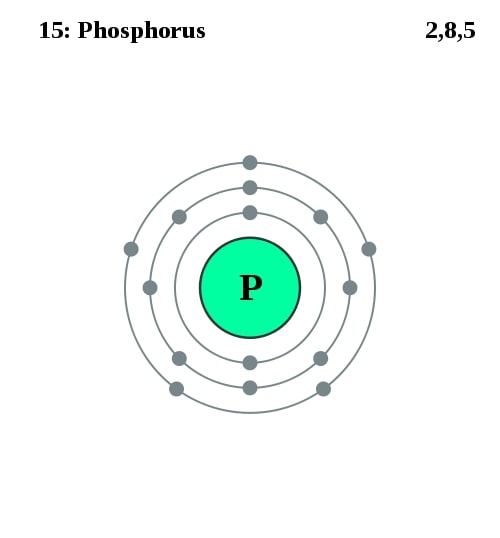
Elektronencofiguratie Bohr
2,8,5
Bij kamertemperatuur
vast
Elektronegativiteit
2,1 (Pauling)
Dichtheid
1820 kg m-3
Atoomstraal
110 . 10-12m
Smeltpunt
44 oC (317 K)
Relatieve atoommassa
30.9738
Kookpunt
281 oC (554 K)
Soortelijke warmte
795 J kg-1K-1
Warmtegeleidingscoëfficiënt
0.235 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Vuurwerk
Onder andere fosfiden en fosforsulfiden worden toegepast voor vuurwerk en voor rookbommen. Bij bijzondere vuurwerksoorten gebruikt men ook wel rode fosfor.
Kunstmest
Fosfor, in de vorm van fosfaten, is onmisbaar voor de groei van planten. Voor een ton aardappelen is ongeveer 1,6 kg nodig, voor een ton graan 10 kg. Als het fosforgehalte van de grond onvoldoende is voor de gewenste productie biedt fosfaathoudende (kunst)mest uitkomst.

Meestal bevat kunstmest mono- of diwaterstoffosfaten, aangezien gewoon fosfaat nogal langzaam wordt opgenomen. De in de natuur voorkomende fosfaten kunnen daartoe met salpeterzuur of fosforzuur worden omgezet:
Als fosfaathoudende kunstmest gebruikt men onder meer:
- Superfosfaat
Uit calciumfosfaat en zwavelzuur: - Dubbelsuper
Uit calciumfosfaat en fosforzuur: - Thomasslakkenmeel.
Fijngemalen hoogovenslak dat calciumfosfaat, ijzeroxide en kalk bevat.
Brandvertrager
Een breed scala aan organische fosforverbindingen is te gebruiken als vlamvertrager in kunststoffen, textiel en andere brandbare stoffen. Vaak bevatten die verbindingen ook één of meer halogenen (met name chloor en broom). Eén van de werkingsmechanismen is dat de verbrandingsproducten van de vlamvertrager (waaronder fosforzuren) een zuurstofafsluitende laag vormen. Ook in blusmiddelen ter bestrijding van grote branden worden fosforverbindingen toegepast.
WC-reiniger
Ontkalkingsmiddellen voor sanitair en voor huishoudelijke apparatuur (onder andere koffiezetapparaten) bevatten vaak een oplossing van fosforzuur.
Tandpasta
In tandpasta zijn fosfaten te vinden als polijst- of schuurmiddellen, bijvoorbeeld:
- Calciumdiwaterstoffosfaat (Ca(H2PO4)2),
- Calciummonowaterstoffosfaat (CaHPO4),
- Magnesiumammoniumfosfaat (MgNH4PO4)
- Calciumpyrofosfaat (Ca2P2O7).

Daarnaast kan het fluorfosfaat bevatten ter voorkoming van tandbederf, bijvoorbeeld natriumfluorfosfaat (Na2PO3F) of 1-hydroxyethaan-1,1-difosfonaat (EHDP).
Voedingszuur, emulgator, antioxidant
Fosforzuur is een natuurlijk bestanddeel van veel vruchten. Sterk verdund fosforzuur heeft een aangename smaak. (Ortho)fosforzuur (E 338) wordt gebruikt als voedingszuur en antioxidant in diverse voedingsmiddelen, zoals cola (0,28 %), kaas, vleeswaren, bier (in flessen).
In combinatie met het zuur worden vaak andere fosfaten toegepast, vanwege hun bufferende (zuurgraad stabiliserende) werking:
- Natriumdiwaterstoffosfaat, E 339-1
- Dinatriummonowaterstoffosfaat, E 339-2
- Natriumfosfaat, E 339-3
- Kaliumfosfaten, E 340
Je vindt ook fosfaten in voedingsmiddelen ter verbetering van de structuur, zoals in puddingpoeder, ijs (stabilsator), vetten (emulgator) en vleeswaren.
Als antiklonteringsmiddel gebruikt men vaak een mengsel van calciumfosfaten, zoals Ca(H2PO4)2, CaHPO4 (E 341 1,2,3).

Bij de bereiding van kaas wordt een mengsel van natriumdiwaterstoffosfaat, natriummonowaterstoffosfaat en natriumfosfaat als emulgator gebruikt.
Smeermiddeladditief
Vrijwel alle moderne smeermiddelen voor motoren bevatten zinkdialkyldithiofosfaat of zinkdiaryldithiofosfaat. Dit gaat oxidatie en slijtage tegen. Ook calciumfosfonaten worden hiervoor gebruikt.
Meer toepassingen
Als element en in legeringen
- Brandbommen (witte fosfor)
- Strijkvlak luciferdoosje (rode fosfor)
- Lichtkogels
- Lichtspoormunitie
- Metaal voor schepen, tandwielen en walsen (Cu/P)
In verbindingen
| Antiklonteringsmiddel (o.a. voor zout) | MgHPO4 |
| Badzout | Na4P2O7 |
| Controle op bederf in graansilo’s | AlP |
| Drogen van gassen | P2O5 |
| Etsen van offset-platen | H3PO4 |
| Fosfateren (beschermen van metaal tegen corrosie) | H3PO4 |
| Geneesmiddel: | |
| – Behandeling van botziekte | EHDP (zie bij tandpasta) |
| – Behandeling van artritis of rheuma | Triethylfosfine |
| – Behandeling van osteoporose | Na2FPO4 |
| – Onderzoek naar uitzaaiing van een gezwel in het skelet | Na2H32PO4 |
| Glas met hoge UV-doorlaatbaarheid | Na3PO4 |
| Kaas- en ijsbereiding | Na4P2O7 |
| Keramiek (bindmiddel) | Al(H2PO4)3, AlPO4 |
| Kippenvoeradditief | Natriumtripolyfosfaat (NTPP Na5P3O10) |
| Krimpvrij maken van wol | H3PO4 |
| Kunstbot | Ca5(F,Cl)P3O12 |
| LED | GaP, GaAsP |
| Lijmbereiding | H3PO4 |
| Lucifers | P4S3, P4S10 |
| Mottenbestrijding | Fosfoniumzouten |
| Noodsignalen in de zeevaart | SrP3, Ba3P14 |
| Preventie zwart worden van aardappelen | Na2H2P2O7 |
| Raketbrandstof | PH3 |
| Textielkleuring | H3PO4 |
| Veevoeder (additief) | NH4H2PO4 |
| Verhogen van het verwekingspunt van asfalt | P2O5 |
| Was- en reinigingsmiddel | (KPO3)x, K4P2O7.3H2O |
| Waterontharder (bijv. in wasmiddel) | Na3PO4, Na4P2O7, Na5P3O10 |
| Waterzuivering | H3PO4 |
Naam & ontdekking
Naam
De naam fosfor is afgeleid van het Griekse woord fosforos voor lichtdragend of lichtbrenger (morgenster). Dit is te danken aan het feit dat witte fosfor – onder invloed van zuurstof – oplicht in het donker.
Ontdekking
Hoewel de Arabische alchemist Alchid Bechil fosfor al in 12e eeuw gekend moet hebben, wordt de ontdekking van fosfor toegeschreven aan de Duitse alchemist Hennig Brand (in 1669). Hij verwerkte daarvoor een grote hoeveelheid urine. Na indampen en herhaald destilleren werd het verkregen mengsel urenlang in een stenen retort verhit. Hierbij kwamen witte nevels vrij die zich als vaste stof op het steen afzetten. De verkregen stof bleek op te lichten in het donker.

Brand hield de ontdekking geheim en verkocht zijn vinding. De bekende Duitse alchemist Johann Kunckel werd daardoor lange tijd als de ontdekker van fosfor beschouwd.
De Engelsman Robert Boyle verbeterde de fosforbereiding rond 1690 door het toevoegen van silicaat. Hierdoor wordt een slak gevormd en is fosfor gemakkelijker te isoleren. Dit principe wordt nog steeds gebruikt.
Voorkomen
Voorkomen
Fosfor valt net buiten de top tien van de meest voorkomende elementen in de aardkorst. Het staat op plaats elf, met een aandeel van 0,10% op gewichtsbasis.
Het is te vinden in een groot aantal mineralen, zoals apatiet (foto) en fluorapatiet [Ca5F(PO4)3]. In veel mindere mate komt ook chloor- en hydroxyapatiet voor.

De gemiddelde mens heeft ongeveer driekwart kilo fosfor in zijn lichaam. Fosfaat is een cruciaal structureel onderdeel van de DNA-keten en van belang voor de energievoorziening van levende cellen. Maar het komt vooral voor in beenderen en tanden, die hoofdzakelijk uit calciumfosfaat bestaan (Ca10CO3(PO4)6).
In materiaal afkomstig van meteorieten is eveneens fosfor aangetroffen, o.a. schreibersiet {(Fe,Ni)3P}.
Winning
De belangrijkste wingebieden (van fosfaten) liggen in de Verenigde Staten van Amerika, Rusland, Kazakstan, Marokko, China, Mexico, Venezuela, Peru, Brazilië, Chili, Australië, Syrië, Jordanië, Palestijn, Finland, Tunesië, Algerije, Mauritanië en vele andere Afrikaanse landen. De EU heeft met de Critical Raw Materials Act in 2022 het element fosfor op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
Fosfor werd vroeger vooral verkregen uit beenderen en guano (een afzetting van verdroogde vogelmest, afkomstig van Peru en een aantal eilanden in de Grote Oceaan).

Tegenwoordig
Fosfor wordt veel bereid door verhitting van (calcium)fosfaat of van fluorapatiet met cokes en grind in een elektrische oven:
Rode fosfor wordt gemaakt door witte fosfor langzaam te verwarmen tot ca. 275 oC en daarna weer langzaam af te koelen.