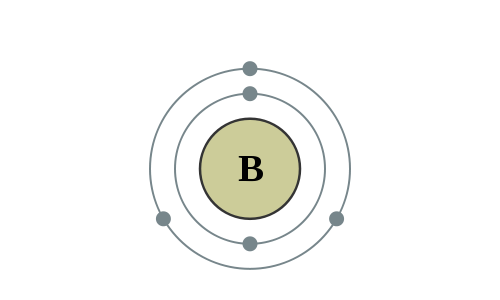
De eigenschappen van het metalloïde boor liggen ergens tussen metalen en niet-metalen in. Het heeft halfgeleidende eigenschappen en is chemisch gezien meer verwant met silicium dan met de andere elementen in groep 13: aluminium, gallium, indium en thallium. Kristallijn boor is diepzwart, bijzonder hard en inert en bestand tegen agressieve kokende zuren zoals waterstoffluoride (fluorzuur) en waterstofchloride (zoutzuur). Fijngemalen lost het wel langzaam op in geconcentreerd waterstofnitraat (salpeterzuur). Verbindingen met boor kennen uiteenlopende toepassingen, van cosmetica tot raketbrandstof. Boriumsilicaatglas heeft een zeer goede temperatuurbestendigheid.
Symbool
B
Protonen/elektronen
Groep
Isotopen
10B, 11B
Periode
2
Elektronenconfiguratie
[He] 2s2 2p1
Blok
p
Elektronencofiguratie Bohr
2,3
Bij kamertemperatuur
vast
Elektronegativiteit
2,0 (Pauling)
Dichtheid
2340 kg m-3
Atoomstraal
88 . 10-12m
Smeltpunt
2075 oC (2348 K)
Relatieve atoommassa
10.811
Kookpunt
4000 oC (4273 K)
Soortelijke warmte
1020 J kg-1K-1
Warmtegeleidingscoëfficiënt
27 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Raketbrandstof
Vaste raketbrandstoffen kunnen zeer fijn verdeeld boorpoeder bevatten. Boor is zeer licht en geeft bij verbranding veel energie per kilogram.
Hittebestendig glas
Boriumsilicaat, een zout van boor en kiezelzuur, bestaat hoofdzakelijk uit siliciumdioxide (SiO2) en boortrioxide (B2O3). Er wordt hittebestendig glas van gemaakt, bekend als borosilicaatglas of boorsilicaatglas. Het meeste laboratoriumglaswerk is van boriumsilicaat gemaakt.

Glasvezel
Uit gesmolten glas zijn vezels te trekken die kunststof materialen kunnen versterken (zogenaamde composieten). Deze lichte en sterke vezels bevatten vaak booroxiden en boorsilicaten. Je vindt ze in een zeer breed scala aan ‘glasvezelversterkte’ producten. Denk daarbij aan sportproducten zoals tennisrackets, hockeysticks en ski’s, maar ook aan high-tech toepassingen in onder andere de lucht- en ruimtevaart. Behalve glasvezels kunnen overigens ook koolstofvezels als versterking voor kunststoffen dienen, evenals lichte, supersterke vezels zoals Kevlar, Twaron of Dyneema.

Een ander soort glasvezels zijn de optische vezels voor datacommunicatie. Deze bestaan grotendeels uit siliciumdioxode (silica, SiO2). Boortrioxide (B2O3) kan worden toegevoegd ter verlaging van de brekingsindex.
Oogontsmetter
Boorwater is een verdunde oplossing van boorzuur, {B(OH)3}. Dit is een zeer mild antisepticum ter ontsmetten van het oog bij lichte ontstekingen.
Wasmiddel
Wasmiddelen kunnen verschillende boorverbindingen bevatten ter verbetering van het wasresultaat. Borax, Na2B4O7 dient als waterverzachter. Natriumperboraat NaBO3 wordt toegevoegd in verband met de blekende werking: bij temperaturen boven 60°C ontleedt het in boraat en zuurstof.

Therapie tegen hersentumoren
Boron neutron capture therapy (BCNT) is een nog gedeeltelijk experimentele therapie voor patiënten met een tumor in hersenen, hoofd of hals. De therapie begint met de toediening van een boorhoudend middel dat wel door kankercellen maar niet door omliggende gezonde cellen wordt opgenomen. De tweede stap is een precieze bestraling met neutronen, waarbij de kern van het booratoom uiteenvalt in een lithiumkern en een alfadeeltje. Het beoogde resultaat is de precisiebestraling en daarmee de vernietiging van de kankercellen.
Snijgereedschap en cosmetica.
Boornitride (BN) kent twee verschillende kristalvormen: kubisch en hexagonaal. De kubische vorm vertoont veel overeenkomst met diamant en heeft een zeer grote hardheid. Deze vorm van boornitride is bijvoorbeeld te vinden in hoogwaardig boor- en snijgereedschap.

De hexagonale vorm van boornitride vertoont veel overeenkomst met grafiet. Het is daardoor toepasbaar als (temperatuurbestendig) smeermiddel. Het speelt ook een rol in cosmetica. Het kleurloze boornitride geeft een glad en zijdezacht gevoel aan foundations en een prachtige parelglans aan lipstick en nagellak. Vanwege de zeer hoge adsorptie van licht is het uitermate geschikt voor het maskeren van rimpels.
Meer toepassingen
Als element en in legeringen
- Absorberen van neutronen bij de bestraling van diverse vormen van kanker – in de experimentele radiotherapie – (12B)
- Doteren van halfgeleiders
- Harden van metalen
- Ontsteking van de airbag
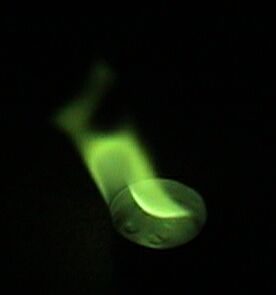
- Vuurwerk (geeft groene kleur)
Toepassingen als ontleedbare stof (verbinding)
| Antisepticum voor huid en slijmvlies | Borax, Na2B4O5(OH)4.8H2O |
| Bleekmiddel voor houtpulp | NaBH4 |
| Brandwerend maken van textiel of hout, blusmiddel | Borax, Na2B4O5(OH)4.8H2O |
| Cosmetica (antimicrobieel middel) | Borax, Na2B4O5(OH)4.8H2O, B2O3 |
| Desinfectie | Borax, Na2B4O5(OH)4.8H2O, NaBO2 |
| Email voor koelkast, wasautomaat, enz. | B2O3, B4C |
| Fosforescerende stof in TL-buizen | (Tb,Ce,Gd,Mg)BO3 |
| Glas dat UV- en röntgenstralen doorlaat | LiBeB4O7 |
| Glaswol | Boorsilicaten |
| Glazuur | Borax, Na2B4O5(OH)4.8H2O |
| Kunstmest | Na3BO3, Na2B4O7.10H2O |
| Porselein | B4C |
| Raketbrandstof | BH3, trimethylaminoboraan (CH3) 3NBH3 |
| Reductiemiddel bij organische syntheses | NaBH4 |
| Regelstaaf in kernreactor | EuB6, B4C |
| Slijp-, schuur en polijstmiddel | B4C |
| Stijven van textiel | Borax, Na2B4O5(OH)4.8H2O |
| Vlekverwijderaar | NaBO2 |
| Vuurvaste materialen | B4C |
Naam & ontdekking
Naam
De benaming boor is afgeleid van het mineraal borax dat al sinds de oudheid wordt toegepast in de bereiding van glas. De Armeense naam voor het mineraal is buraq, de Perzische burah. De Engelsen noemen het element boron, een samenvoeging van borax en carbon. Deze naam geeft zowel de herkomst aan (het mineraal borax) als de overeenkomst met koolstof. Boor werd lange tijd als een vorm van koolstof gezien.
Ontdekking
De eerste keer dat elementair boor werd gezien was in 1808, door de Fransen Joseph-Louis Gay-Lussac (foto) en Louis Jaques Thénard. Zij kregen het in handen door de reactie van boorzuur (H3BO3) met kalium. In hetzelfde jaar slaagde de Engelsman Humphry Davy er in om boor te bereiden door elektrolyse van boorzuur.

Voorkomen
Voorkomen
Het aandeel van boor in de aardkorst bedraagt 1.10-3 % (op basis van gewicht). Het element staat op plaats 37 in de rangorde van voorkomen.

Boor is te vinden in zeer veel mineralen (boraten en boorcarbonaten). De belangrijkste zijn:
| Boraciet | Mg3B7O13Cl |
| Borax | Na2B4O5(OH)4.8H2O |
| Colemaniet | Ca2B6O11.5H2O |
| Hambergiet | Be2BO3(OH) |
| Kerniet | Na2B4O6(OH)2.3H2O |
| Ulexiet | NaCaB5O6(OH)2.5H2O (zie afbeelding) |
Winning
De belangrijkste wingebieden liggen in de Verenigde Staten van Amerika (o.a. de plaats Boron in Californië), Rusland, Kazakstan, Turkije, China en Argentinië.
De EU heeft met de Critical Raw Materials Act in 2022 het element boor op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
De allereerste bereiding vond plaats door de Fransen Joseph-Louis Gay-Lussac en Louis Jaques Thénard via de reactie van boorzuur (H3BO3) met kalium. De Engelsman Humphry Davy slaagde er in om boor te bereiden door elektrolyse. Het boor was in beide gevallen verre van zuiver. In 1892 maakte de Franse chemicus Henri Moissan (foto) boor met een zuiverheid van 95-98% door reductie van boorzuur met magnesium.

In 1909 was de Amerikaanse chemicus Ezekiel Weintraub de eerste die vrijwel zuiver boor in handen kreeg na reductie van boortrichloride met waterstof. Het duurde tot 1950 voordat chemici er in slaagden zeer zuiver boor in kristalvorm te verkrijgen.
Tegenwoordig
Grootschalige productie van boor gebeurt meestal uit de mineralen borax of kerniet. Na verrijking wordt het erts geoxideerd tot boortrioxide, dat op verschillende manieren tot zuiver boor kan leiden:
- Via het omzetten van het oxide in gasvormig boorchloride en dit vervolgens reduceren met zinkdamp bij ca. 900 °C. Hierbij ontstaat vrij zuiver kristallijn boor.
- Door reductie van het gasvormig trichloride met waterstof op tantaal (bij ca. 1200 °C). Hierbij wordt zeer zuiver kristallijn boor gevormd.
- Via reductie van het oxide met magnesium (of met een ander zeer onedel metaal zoals natrium, kalium of calcium):
(Dit levert boor op van 95-98% zuiverheid, dat geen kristallijne structuur bezit.) - Door het smelten met een mengsel van kaliumchloride en kaliumfluoride, waarbij kaliumboorfluoride (KBF4) ontstaat. Dat levert bij elektrolyse poedervormig boor (95 %) op.