Deze oefentoets bestaat uit vijf vragen.
De uitwerking vind je na het openen van alle hints. Let op, als er geen ‘Controleer antwoord’ knop staat, moet je zelf je antwoord controleren met behulp van de hints en uitwerking.
Vraag 1
Met de melkzuursensor wordt de concentratie van melkzuur in het zweet bepaald. De elektrochemische cel van de melkzuursensor is hieronder vergroot en schematisch weergegeven:
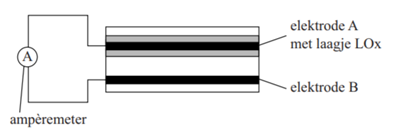
Elektrode A is gemaakt van grafiet (koolstof) en is bedekt met het enzym lactaatoxidase (verder afgekort als LOx). Zweet fungeert als elektrolyt. Onder invloed van LOx wordt melkzuur (C3H6O3) omgezet tot pyrodruivenzuur (C3H4O3). Melkzuur treedt in deze reactie op als reductor.
Zweet is een oplossing waarin verschillende stoffen zijn opgelost. Doordat in zweet een bepaald soort deeltjes voorkomt, kan zweet als elektrolyt dienen.
Vraag 2
In 2019 kregen de ontdekkers van de lithiumbatterij de Nobelprijs voor de scheikunde.
Hieronder is een schematische voorstelling van een soort lithiumbatterij tijdens stroomlevering te zien. Eén pool is gemaakt van lithium, de andere van koolstof. Tussen de polen bevindt zich papier dat doordrenkt is met een geleidende vloeistof.
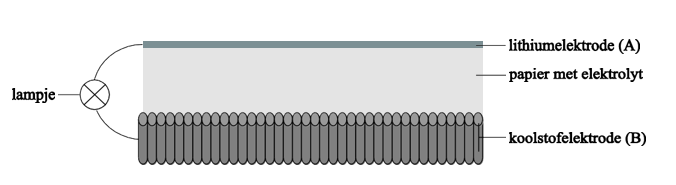
Aan elektrode A vindt de volgende halfreactie plaats:
Li 🡪 Li+ + e–
De koolstofelektrode kan Li atomen binden. De binding van de Li atomen aan koolstof is zelfs sterker dan de binding tussen de Li atomen onderling in de lithiumelektrode. Bij stroomlevering komen de Li+ ionen los uit de lithiumelektrode, bewegen naar de koolstofelektrode en worden uiteindelijk als Li atomen aan de koolstof gebonden.Er worden twee Li atomen per zes koolstofatomen gebonden volgens de volgende halfreactie:
2 Li+ + 6 C + 2 e- 🡪 C2Li6
De stroomlevering stopt als voor de koolstofelektrode geldt dat per zes koolstofatomen twee Li atomen zijn gebonden. Aan de andere elektrode is dan nog steeds lithium aanwezig. De capaciteit van een batterij kan worden gedefinieerd als de hoeveelheid elektronen die deze batterij kan leveren. Voor deze lithiumbatterij wordt de capaciteit bepaald door het aantal koolstofatomen in de koolstofelektrode.
Vraag 3
Rijden onder invloed van alcohol (ethanol) is gevaarlijk en verboden. Daarom voert de politie controles uit en meet daarbij het alcoholgehalte in de adem van de bestuurder. Als een bestuurder een overtreding heeft begaan, kan een rechter oordelen dat een ‘alcoholslot’ in de auto van deze bestuurder moet worden aangebracht. Een alcoholslot is een startonderbreker in de auto. Voor het wegrijden moet de bestuurder in het pijpje van het alcoholslot blazen. Wanneer de bestuurder te veel alcohol heeft gedronken, start de auto niet.

Het alcoholslot bevat een soort brandstofcel. Als de uitgeademde lucht alcohol bevat, reageert de alcohol als reductor aan de ‘actieve’ elektrode van de cel. De vergelijking van deze halfreactie is:
C2H6O + 3 H2O 🡪 2 CO2 + 12 H+ + 12 e–
Aan de andere elektrode reageert zuurstof als oxidator in zuur milieu.
De stroom die door de brandstofcel loopt is een maat voor het alcoholgehalte in de uitgeademde lucht. Het alcoholgehalte in lucht en het alcoholgehalte in vocht zijn met een vaste omrekeningsfactor aan elkaar gerelateerd. Een gehalte van 0,44 mg per L lucht komt overeen met 1,0 g per L lichaamsvocht. Als het alcoholgehalte in het lichaamsvocht van de bestuurder hoger is dan 0,02 massaprocent, start de auto niet.
Bij een bepaalde bestuurder passeren 50·10–6 mol elektronen per L uitgeademde lucht de actieve elektrode.
Vraag 4
In de Toyota Prius is de batterij een nikkel-metaalhydride-batterij, afgekort NiMH-batterij. De ene elektrode (A) van de NiMH-batterij is gemaakt van nikkel-oxyhydroxide, NiO(OH). De andere elektrode (B) bestaat uit een metaalhydride. Het metaalhydride wordt weergegeven met MH. De elektrolyt in een NiMH-batterij is een KOH-oplossing.
Wanneer de batterij stroom levert, vinden in de NiMH-batterij de volgende halfreacties plaats:
elektrode A: NiO(OH) + H2O + e– 🡪 Ni(OH)2 + OH–
elektrode B: MH + OH– 🡪 H2O + M + e–
In een handleiding van de Toyota Prius staat onder andere de volgende informatie: Bij afnemende snelheid, zoals bij afremmen, zet de auto bewegingsenergie om in elektrische energie waarmee de batterij wordt opgeladen.