Cesium is één van de drie metalen met een ‘gouden’ uiterlijk, naast koper en – uiteraard – goud. De rest van de metalen is grijs of zilverwit. Het alkalimetaal cesium is zacht, makkelijk vervormbaar en smelt al bij 29 graden Celsius. Het is het meest elektropositieve en alkalische element dat er is, en het meest reactieve metaal. Cesium zelf reageert explosief met water onder de vorming van waterstof en cesiumhydroxide: een zeer sterke base die zelfs glas kan aantasten. De seconde is gedefinieerd aan de hand van de energieniveaus van een cesium-atoom. Uiterst precieze atoomklokken op basis van cesium kennen een afwijking van minder dan één seconde in vele miljoenen jaren.
Symbool
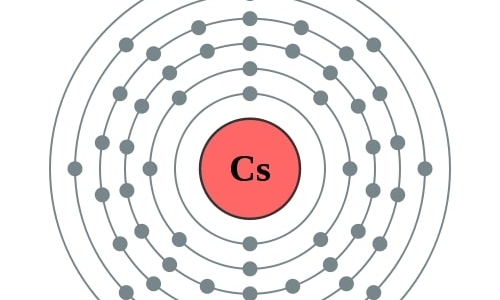
Cs
Protonen/elektronen
Groep
Isotopen
133Cs
Periode
6
Elektronenconfiguratie
[Xe] 6s1
Blok
s
Elektronencofiguratie Bohr
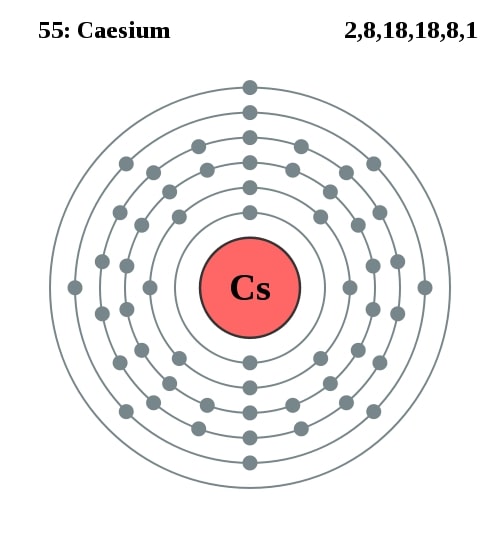
2,8,18,18,8,1
Bij kamertemperatuur
vast
Elektronegativiteit
0,9 (Pauling)
Dichtheid
1870
Atoomstraal
262 . 10-12m
Smeltpunt
29 oC (302 K)
Relatieve atoommassa
132.905
Kookpunt
671 oC (944 K)
Soortelijke warmte
240 J kg-1K-1
Warmtegeleidingscoëfficiënt
35,9 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Atoomklok
Het 133Cs atoom definieert sinds 1967 de standaard van tijd, de seconde. De referentie is een specifieke ‘hyperfijne’ energetische overgang in de grondtoestand van het 133cesium atoom (in rust, bij 0 K). De daarmee corresponderende straling heeft volgens de definitie uit 1967 een frequentie van 9.192.631.770 Hz. Anders gezegd: één seconde is precies de duur van 9.192.631.770 perioden van die straling.
In een atoomklok wordt de betreffende energie-overgang gebruikt voor het afstemmen van een microgolfgenerator. De geproduceerde microgolfstraling drijft vervolgens als het ware de klok aan. De enorme precisie wordt pas bereikt als het lukt de referentie-atomen sterk af te koelen (zover mogelijk richting 0 K) en om te corrigeren voor ongewenste bijwerkingen van de opstelling. Het National Institute of Standards and Technology (NIST) in de Verenigde Staten beschikt over ’s werelds meest nauwkeurige atoomklok. Deze heeft een afwijking van slechts één seconde in 138 miljoen jaar.

Foto-elektrische cel
Foto-elektrische cellen met cesium houdende verbindingen zijn vooral gevoelig voor infrarood licht. De kathode van zo’n foto-elektrische cel bestaat uit cesiumoxide (Cs2O en CsO), eventueel in combinatie met galliumarsenide (GaAs), cesiumantimonide (Cs3Sb) en -bismutide (Cs3Bi). Als er licht op deze verbindingen valt, worden er elektronen vrijgemaakt, waardoor een elektrische stroom ontstaat.
Gammabestralingsbron
Het isotoop 137Cs, met een halfwaardetijd van 27 jaar, kan als bron voor gammastraling dienen. Het is relatief goedkoop omdat het een bijproduct is van de kernsplitsing van uranium in kernreactoren. Gammastraling kent vele industriële toepassingen, onder andere voor het steriliseren van voedsel en voor meetinstrumenten. In de geneeskunde werd 137Cs gebruikt voor de bestraling van onder andere baarmoederhals- en blaaskanker.
Infraroodlamp
Infraroodlampen zijn voorzien van cesium of cesiumchloride als gasvanger (getter). Het bindt onzuiverheden zoals sporen van zuurstof en stikstof. Ook röntgen- en andere vacuümbuizen maken gebruik van dergelijke gasvangers.

Stuurraketbrandstof
Ionenmotoren voor de besturingssystemen van satellieten (de stuurraketten) beschikken vaak over het hoogenergetische cesiumboorhydride (CsBH4) als brandstof. Er zijn ook stuurrakketen met zeer fijn verdeeld cesium als brandstof. Het cesium kan 140 maal zoveel energie leveren als een zelfde hoeveelheid ‘gewone’ brandstof.
Boorvloeistof
Bij de oliewinning wordt veel gebruik gemaakt van waterige oplossingen van cesiumformiaat (HCOO–Cs+). Deze dienen onder andere als smering van de boorkop, brengen het boorgruis naar de oppervlakte en zorgen voor een constante boordruk.
Meer toepassingen
Als element en in legeringen
- Diktemeting van o.m. papier, metaal, beton (137Cs)
- Gelijkrichter (Cs-damp)
- Gloeikathode
- Katalysator voor organische hydrogenatie
- Nucleaire batterij (137Cs)
In verbindingen
| glas, keramiek | Cs2CO3 | |||
| infraroodprisma | CsI | |||
| katalysator bij polymerisatiereacties | Cs2CO3, CsOH | |||
| prisma's, lenzen en vensters voor infraroodapparatuur | CsI-kristallen | |||
| röntgendetector (zie I-53) | CsI | |||
| scintillatieteller | CsCl, -Br, -I |
Naam & ontdekking
Naam
De naam cesium is afgeleid van het Latijnse caesius dat hemelsblauw betekent. Twee helderblauwe lijnen karakteriseren het emissiespectrum van cesium.

Ontdekking
De Duitsers Robert Wilhelm Bunsen (chemicus) en Gustav Robert Kirchhoff (natuurkundige, foto) toonden het nieuwe element in 1860 aan in het mineraal lepidoliet en in droge dampresten van mineraalwater uit Bad Dürkheim. Ze maakten gebruik van vlamspectroscopie – cesium is het eerste element dat met deze methode werd ontdekt.
In 1882 maakte de Duitse chemicus Carl Setterberg het eerste metallische cesium door elektrolyse van een gesmolten mengsel van cesium- en bariumcyanide (CsCN, Ba(CN)2).
Voorkomen
Voorkomen
Cesium staat op plats 47 in de ranglijst van meest voorkomende elementen in de aardkorst, met een aandeel van 3.10-4 %. Het is vooral te vinden in mineralen als
| polluciet (foto) | (Cs,Na)2Al2Si4O12.H2O | |||
| rhodiziet | (K,Cs)2Al4Be4(B,Be)12O28|
| |

En in zeer kleine hoeveelheden voor in de mineralen:
| beryl | Be3Al2Si6O18 | |||
| lepidoliet | K(Li,Al)3(Si,Al)4O10(F,OH)2 | |||
| trifilien | LiFe+2PO4 |
Ook bronwater, zeewater, akkeraarde en verbrandingsresten van planten bevatten kleine hoeveelheden cesiumverbindingen.
Winning
Polluciet is het enige mineraal waaruit cesium commercieel te winnen is. De belangrijkste wingebieden liggen in Zimbabwe, de Verenigde Staten van Amerika, Canada, Rusland, Namibië en Elba.
Bereiding
Bereiding
Vroeger
In 1882 maakte de Duitse chemicus Carl Setterberg het eerste metallische cesium door elektrolyse van een gesmolten mengsel van cesium- en bariumcyanide (CsCN, Ba(CN)2).

Tegenwoordig
Cesium wordt op verschillende manieren geïsoleerd. Voorbewerking van het mineraalpolluciet resulteert in verschillende cesiumverbindingen. Dit levert vervolgens elementair cesium via
- Reductie (in vacuüm) van gesmolten cesiumchloride, -hydroxide of -carbonaat met magnesium, calcium, aluminium, waterstof of calciumcarbide, gevolgd door destillatie.
- Elektrolyse van gesmolten cesiumzouten.
Op kleine schaal is zeer zuiver cesium te bereiden door ontleding van cesiumnitride (CsN3).