Iridium is één van de zeldzaamste metalen. Het komt uiterst weinig voor in de aardkorst, maar is wel aanwezig in meteorieten. De ontdekking van een dun laagje iridium in gesteenten wordt daarom geassocieerd met de inslag van de grote meteoriet die de dinosauriërs deed uitsterven. Het element dankt zijn naam aan de regenboog (Latijn: iris) vanwege de veelkleurige zouten. Metallisch iridium is hard en zilverachtig. Je vindt het soms in injectienaalden en op de punt van dure vulpennen.
Symbool
Ir
Protonen/elektronen
Groep
Isotopen
191Ir, 193Ir
Periode
6
Elektronenconfiguratie
[Xe] 6s2 4f14 5d7
Blok
d
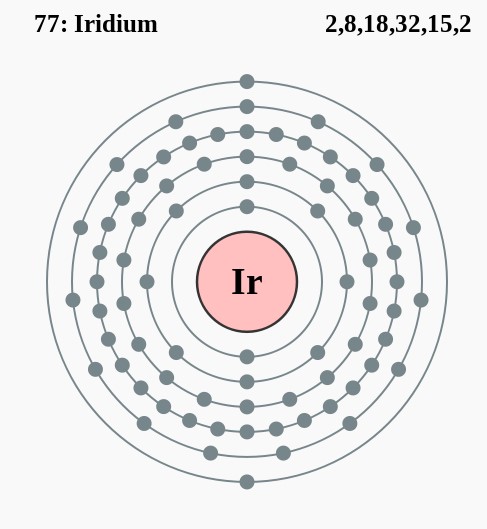
Elektronencofiguratie Bohr
2,8,18,32,15,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,6 (Pauling)
Dichtheid
22600 kg m-3
Atoomstraal
135 . 10-12 m
Smeltpunt
2446 oC (2719 K)
Relatieve atoommassa
192.2
Kookpunt
4428 oC (4701 K)
Soortelijke warmte
131 J kg-1K-1
Warmtegeleidingscoëfficiënt
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Injectienaald
In speciale soorten injectienaalden past men een legering toe van ongeveer zeventig procent platina en dertig procent iridium. Zulke naalden zijn zeer sterk en hard. Ze zijn bovendien zeer scherp te slijpen, zodat je de prik bijna niet voelt.
Vulpenpunt
Een vulpenpunt moet zeer corrosiebestendig, sterk en hard zijn. Voor de duurdere vulpennen gebruikt men daarom legeringen van platina of osmium met iridium, of zelfs zuiver iridium. Daarvoor wordt een kogeltje iridium op het edelstaal van de pen aangebracht. Daarna werkt men de pen punt verder af.
Standaardmeter
Tot 1960 gold een metalen staaf opgeslagen in Sèvres bij Parijs als de ‘standaardmeter’. Het was de referentie voor alle meetapparatuur voor lengtes en afstanden. De staaf was uitgevoerd in een legering van negentig procent platina en tien procent iridium. Deze is onaantastbaar, heeft een grote hardheid en een extreem lage uitzettingscoëfficiënt.

(In 1960 werd de eenheid van lengte gerelateerd aan de golflengte van het licht van de oranje-rode lijn in het spectrum van 86Kr. Sinds 1983 is de meter gedefinieerd als precies de afstand die licht aflegt in 1/299.792.458 deel van een seconde.)
Bougie
Legeringen met iridium zijn zeer hard, corrosiebestendig en goed bestand tegen de inwerking van vonken. Ze worden daarom gebruikt in contactpunten van zeer betrouwbare bougies voor helikopter- en vliegtuigmotoren. Ook auto’s vind je soms dit soort bougies.

Bestraling tumoren
Het radioactieve isotoop iridum-192 zendt bèta- en gammastralen uit. Men past het toe voor de bestraling van tumoren in de vorm van een lang en dun staafje. Dit is bijvoorbeeld via een katheter op de juiste plaats te brengen. Deze minimaal invasieve methode wordt onder andere toegepast bij long-, borst-, baarmoederhals- en prostaatkanker.
Naast de medische toepassing wordt deze isotoop ook gebruikt voor de controle van het laswerk in bijvoorbeeld pijpleidingen en huidplaten van schepen, voor de bepaling van de dikte van schoorsteenwanden en voor niveaumetingen (gammagrafie).
Meer toepassingen
Als element en in legeringen
- Elektroden, o.a. bij chloorproductie
- Katalysator, bijv. bij de bereiding van azijnzuur
- Laboratoriumapparatuur
- Onderdelen van precisie-instrumenten
- Ruimtevaart: huls voor de splijtstof in nucleaire batterijen
- Sieraden (10 % Ir)
- Tandheelkundige legeringen (vanwege hardheid en onaantastbaarheid)
- Thermo-element tot 2.200 *C (rhodium/iridium legering)
In verbindingen
- Complexe iridiumverbindingen dienen als katalysator voor het hydrogeneren van organische verbindingen
Naam & ontdekking
Naam
De naam iridium is afgeleid van iris, het Griekse woord voor regenboog. Dit vindt zijn oorsprong in de grote verscheidenheid aan kleuren in iridiumzouten.

Ontdekking
De Engelse chemicus Smithson Tennant (foto) ontdekte iridium in 1803 in het residu dat ontstaat bij de verwerking van platina-erts. Het platina lost op in koningswater, maar er ontstaat ook een donkere, onoplosbare neerslag. Andere chemici veronderstelden dat dit koolstof zou zijn, maar Tennant was een andere mening toegedaan. Hij had de nodige ervaring met koolstof; zo toonde hij als eerste aan dat diamant een vorm van zuiver koolstof is. Dankzij een uitgekiende chemische behandeling van het residu ontdekte Tennant zowel osmium als iridium.

Tennant was de zakenpartner van William Hyde Wollaston (foto) die veel geld wist te verdienen met de verwerking van platina-erts. Wollaston is de ontdekker van palladium (1802) en rhodium (1804), ook in ruw platina.
Voorkomen
Voorkomen
Met een gewichtsaandeel van 1.10-7 % van de aardkost staat iridium op een gedeelde 77e plaats in de lijst van meest voorkomende elementen (samen met ruthenium, rhodium en tellurium).
De kern van de aarde bevat naar alle waarschijnlijkheid meer iridium. Dit leidt men af uit het feit dat ook op de zon en in meteorieten iridium is aangetroffen.
Iridium komt meestal in metallische (‘gedegen’) toestand) voor in de ertsen van de platinametalen en van goud. Er zijn enkele (zeldzame) mineralen die iridium bevatten, zoals irarsiet (Ir,Ru,Rh,Pt)AsS, iridarseniet (Ir,Ru)As2 en kashiniet (Ir,Rh)2S3.
Winning
De belangrijkste wingebieden liggen in Zuid-Afrika, Rusland (West-Siberië), Canada, Tasmanië, Indonesië (Kalimantan) en Japan. Iridium wordt voornamelijk verkregen uit het anodeslib bij de bereiding van nikkel.
Bereiding
Bereiding
Vroeger
De eerste bereiding van iridium vond plaats door het oplossen van ruw platina in koningswater, waarna het residu (na smelten met lood) werd behandeld met zuur of alkali. Daarbij ontstaan de oxiden van respectievelijk osmium en iridium. In het geval van iridium is het metaal te verkrijgen via omzetting van het oxide in (NH4)3[IrCl6] gevolgd door reductie met waterstof.

Tegenwoordig
Iridium is op verschillende manieren te bereiden de mineralen die platinametalen bevatten. Deze worden opgelost in koningswater. Na een aantal bewerkingen ontstaat uiteindelijk iridiumchloride (IrCl2), dat wordt omgezet in het complex (NH4)3[IrCl6]. Door reductie met waterstof of via elektrolyse verkrijgt men het iridium.
Iridium is ook te winnen uit restanten bij de nikkel-, platina– en koperwinning. Het in koningswater onoplosbare deel wordt gesmolten met natriumwaterstofsulfaat (NaHSO4) en opgelost in water. Het onoplosbare deel dat daarna overblijft smelt men met natriumperoxide (Na2O2). Na toevoegen van water blijft iridium(IV)oxide (IrO2) achter, dat men oplost in koningswater. Het toevoegen van ammoniumchloride leidt vervolgens tot de vorming van het complex (NH4)3[IrCl6]. Na zuivering wordt deze verbinding gereduceerd met waterstof.
Naast deze ‘klassieke’ methode maakt men steeds meer gebruik van vloeistof-vloeistofextractie en ionenwisseling om de platinametalen te scheiden.
Vaak wordt iridium overigens niet gescheiden van de andere platinametalen (bijvoorbeeld osmium) maar verwerkt tot een direct te gebruiken legering.