IJzer is het op vijf na belangrijkste element in het heelal. Kernfusie in sterren leidt tot steeds zwaardere atomen, maar nooit zwaarder dan ijzer. In de kern van de aarde is zoveel ijzer aanwezig, dat het element alles bij elkaar ongeveer een derde van het planeetgewicht voor zijn rekening neemt. Het aandeel van ijzer in de aardkorst is ongeveer zes procent. In de oudheid, toen men alleen ijzer uit meteorieten benutte, was ijzer acht keer duurder dan goud. IJzer is het enige element waarnaar een geschiedkundig hoofdtijdperk is genoemd. Dankzij de verbetering van het hoogovenproces door de toepassing van cokes werd het mogelijk op grootschalige wijze kwalitatief goed ijzer te bereiden. Dit luidde het begin in van de industriële revolutie. IJzer heeft een aantal belangrijke biologische functies. Het is een belangrijk bestanddeel bij het vastleggen van zonne-energie door groene planten. Het verzorgt de zuurstofbinding in het hemoglobine in rode bloedcellen. IJzer is essentieel voor de ontwikkeling van onze hersenen. Een ijzertekort kan – onder andere – tot gevolg hebben dat kinderen minder goed leren.
Symbool
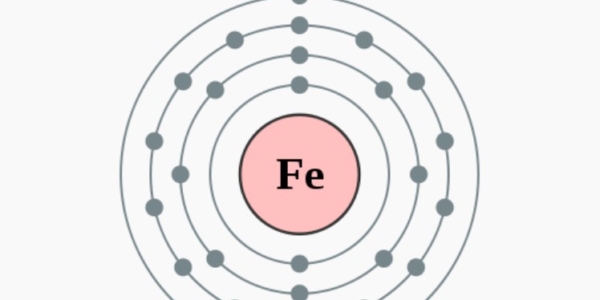
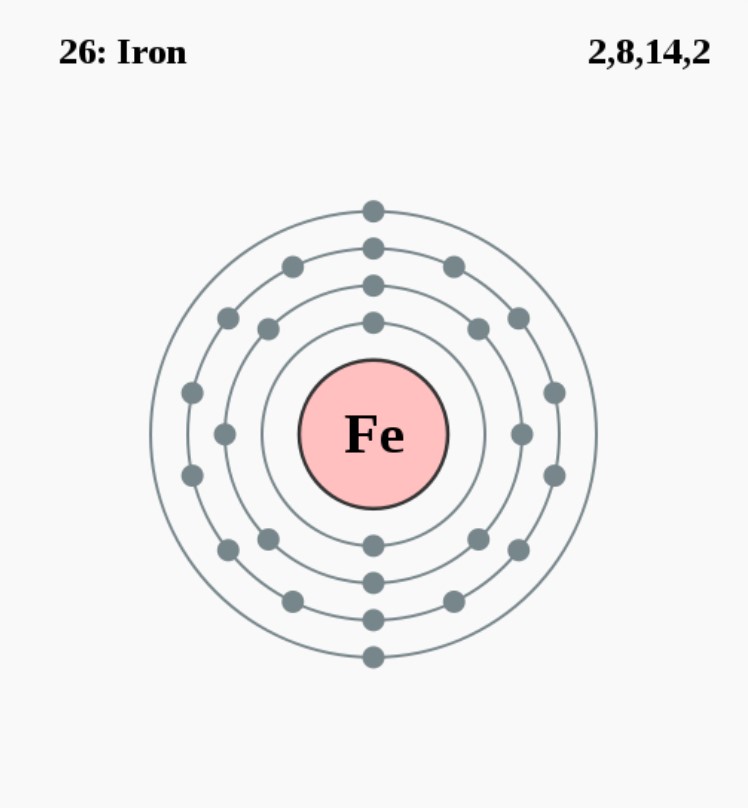
Fe
Protonen/elektronen
Groep
Isotopen
54Fe, 56Fe, 57Fe, 58Fe
Periode
4
Elektronenconfiguratie
[Ar] 4s2 3d6
Blok
d
Elektronencofiguratie Bohr
2,8,14,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,6 (Pauling)
Dichtheid
7870 kg m-3
Atoomstraal
126 . 10-12 m
Smeltpunt
1538 oC (1811 K)
Relatieve atoommassa
55.847
Kookpunt
2861 oC (3134 K)
Soortelijke warmte
460 J kg-1K-1
Warmtegeleidingscoëfficiënt
80.4 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Bij een element als ijzer geeft zelfs een lange lijst toepassingen nog maar een bescheiden inzicht in het werkelijke gebruik. IJzer wordt het meest toegepast van alle bekende metalen, vooral in de vorm van staal (een legering van ijzer met koolstof).
Fiets
Traditionele fietsen worden gemaakt van constructiestaal. Met sterkere legeringen kunnen dunnere buizen gemaakt worden. Hierdoor worden de fietsen lichter. De gebruikte staalsoort hangt ook af van de productiemethode. Zo vereist inductielassen een ander soort constructie staal dan ‘klassiek’ lassen.

Auto
De moderne auto kent een beschermende ‘kooiconstructie’ uit speciale staalsoorten die in staat zijn veel energie op te nemen tijdens een botsing. Ook voor het plaatwerk zijn speciale staalsoorten ontwikkeld, die hoge weerstand bieden tegen de vorming van ‘gebruiksdeukjes’. Automobielstaal wordt vrijwel altijd voorzien van een laagje zink om corrosie tegen te gaan. Zwaarbelaste onderdelen zoals de remtrommel en de krukas in de motor worden gemaakt van zogenoemd nodulair gietijzer. Door de toevoeging van een zeer kleine hoeveelheid magnesium is dat veel minder bros dan het traditionele gietijzer.
Brug
Het ultieme voorbeeld van het gebruik van constructie ijzer. De eerste (giet)ijzeren brug ter wereld werd gebouwd in Engeland tussen 1777 en 1779. Ze overspant de rivier de Severn in het dorp Ironbridge (foto) (even ten noordwesten van Birmingham). Voor de bouw van bruggen worden diverse soorten constructiestaal gebruikt. Tot de verbeelding sprekende bruggen zijn het Franse Viaduc de Millau (’s werelds hoogste en langste meervoudige hangbrug), de Japanse Akashi-Kaikyo brug (met een overspanning van 1991 meter de grootste brug ter wereld) en natuurlijk de Golden Gate bridge in San Francisco (Verenigde Staten). In Nederland heeft de Van Brienenoordbrug (Rotterdam) de grootste overspanning (305 meter).

Boot
Grote transportschepen worden gemaakt van constructiestaal. Soms wordt ook roestvrij staal of aluminium toegepast.
Machine
Gietijzer is een veelgebruikt materiaal voor machineonderdelen zoals lagers, ringen en dergelijke. Afhankelijk van de toepassing is aan het ijzer koolstof (2-5 %), silicium (0,5 à 4 %), mangaan ( 0,5 – 1 %) of een ander metaal toegevoegd.
Onderdelen voor elektrische machines bevatten ijzer met een beetje silicium. Dit soort ijzer is giet- en smeedbaar en hittebestendig. Voor machineonderdelen die zwaar en stotend belast worden, gebruikt men gietstaal dat 0,2 à 0,5 % koolstof bevat.
Een andere veel gebruikte soort is nikkelstaal. Het bevat – afhankelijk van de toepassing – 2 tot 40 % nikkel.
Magneet
Permanente magneten bevatten ijzer in bijzondere legeringen, bijvoorbeeld met nikkel (tot 28 %), kobalt (tot 20 %), aluminium (tot 12 %), chroom (tot 9 %) of molybdeen (tot 1,5 %). De magnetische werking daarvan is vele malen groter dan die van ijzer. Bekende magnetische legeringen zijn fernico en triconal.

Conservenblik
Conservenblikken zijn gemaakt van staal bedekt met een beschermend laagje tin of kunststof (bijvoorbeeld epoxyhars). Dat gaat corrosie tegen en voorkomt ongewenste wisselwerking met de inhoud. Voor dankblikjes maakt men in toenemende mate van aluminiumlegeringen gebruik.
Gereedschap
De fabricage van gereedschappen, meet- en snijapparatuur, precisiemachines en allerlei andere apparaten vereist een zeer harde, corrosie bestendige en stabiele (temperatuurbestendige) staalsoort. Dit is meestal staal, met 0,9 – 1,5 % koolstof en daarnaast legeringselementen als chroom, aluminium of silicium. Soms wordt ook molybdeen, nikkel, vanadium, kobalt of wolfraam toegevoegd, afhankelijk van de beoogde toepassing.
Roestvrij stalen (snij)gereedschap is gemaakt van staal met circa 13 % chroom.
Spijker
De ‘spijkers’ die doe-het-zelvers en timmerlui gebruiken in houten constructies heten formeel draadnagels. Ze zijn gemaakt van staaldraad, dat volautomatisch op lengte wordt gebracht en vrijwel tegelijkertijd van punt en kop voorzien.

Waterzuivering
Verbindingen van ijzer zoals ijzer(III)sulfaat (Fe2(SO4)3) en -chloride (FeCl3) helpen zwembad- en rioolwater te zuiveren vijvers helder te houden. Ze binden fosfaten uit het water, en destabiliseren colloïdaal vuil dat normaliter niet via de filters uit het water is te halen (denk daarbij aan microscopisch kleine resten van algen, bacteriën en bijvoorbeeld huidschilfers).
Bij het oplossen van de ijzer(III)zouten treden onder andere de volgende reacties met water op:
en
De daarbij gevormde deeltjes destabiliseren de colloïdale oplossing, waardoor er een neerslag ontstaat die is af te filtreren.
In vijvers wordt ook wel een zuiverend effect bereikt door een stuk roestend ijzer op de bodem te leggen.
Meer toepassingen
Als element en in legeringen
- Katalysator voor de ammoniakbereiding
- Wapening van beton
In verbindingen
| Beitsmiddel | FeCl2, FeCl3, Na- of KFe(SO4)2, Fe2(SO4)3 |
| Desinfectiemiddel | FeSO4 |
| Elektrische geleider | Fe3O4 |
| Etsen van aluminium | FeSO4 |
| Geluidsbanden | Ijzeroxiden, vnl. Fe2O3 |
| Geneesmiddel | |
| - Tegen bloedarmoede/ijzertekort | FeC4H2O4 en andere ijzerverbindingen |
| - Stoppen van bloedingen; bloedstolling | FeCl3 |
| Houtconservering | Fe(CH3COO)3, FeSO4 |
| Inktbereiding | FeSO4.7H2O |
| Katalysator bij de ontzwaveling van gassen | Fe(OH)3 |
| Kleurstof in schmink en poeder | Fe2O3 |
| Kleurstof voor keramiek, email | FeS |
| Kleurstoffen | |
| - Berlijns blauw | KFeFe(CN)6 |
| - Geel | Fe2(CrO4)3 |
| Kleurstoffen voor voedingsmiddelen (E172) | Fe-oxide/hydroxide |
| Onkruidbestrijding (o.a. tegen mos in het gazon) | FeSO4 |
| Pigmenten, o.a. voor gummi, linoleum, kunststof, verf en papier | Ijzeroxiden |
| Polijstmiddel voor glas en diamant | Fe2O3 |
Naam & ontdekking
Naam
De naam ijzer is naar alle waarschijnlijkheid afkomstig van het Middelnederlandse woord isen. Dat is op zijn beurt afgeleid van het Gotische woord eisarn of het Oudsaksische isarn, op hun beurt afkomstig van het Oudkeltische isarno.
Er is wellicht enig verband met het Latijnse woord ira, wat toorn betekent, vanwege de kracht van het materiaal. Het latere Latijnse woord is ferrum, waarvan ook het symbool Fe is afgeleid.
Ontdekking
IJzer was reeds in de Oudheid bekend. Het eerst gebruikte ijzer (ca. 4000 v. Chr.) is vermoedelijk afkomstig van bepaalde meteorieten (foto) waarin metallisch ijzer voorkomt (mineralogen spreken dan van ‘gedegen’ ijzer).

De hittieten waren waarschijnlijk de eerste mensen die met behulp van houtskool ijzererts in ijzer wisten om te zetten. Pas met de uitvinding van de hoogoven was men in staat staal in grotere hoeveelheden te produceren. Chinezen waren al in de 5e eeuw v.Chr. bekend met het hoogovenproces; in Europa ontdekte men het pas in de 13e eeuw. De volgende belangrijke technologische innovatie was het gebruik van cokes in plaats van houtskool aan het begin van de 18e eeuw. Dit luidde het begin van de industriële revolutie in.
De ijzertijd is het geschiedkundige hoofdtijdperk dat zich kenmerkt door het veelvuldige gebruik van ijzer. In West-Europa begint de ijzertijd omstreeks 800 v.Chr. en eindigt als de Romeinen naar de Lage Landen komen (ongeveer het begin van onze jaartelling). In België en het zuiden van Nederland werden ijzeren voorwerpen gangbaar rond 700 v.Chr., in Noord-Nederland ongeveer een eeuw later.

Voorkomen
Voorkomen
Het aandeel van ijzer in de aardkorst is 5,63 % (op basis van gewicht). Het is daar het op drie na meest voorkomende element (na zuurstof, silicium en aluminium).
Vooral in de kern van de aarde is enorm veel ijzer te vinden. Men schat dat ijzer goed is voor ongeveer een derde van de totale massa van de aarde. Uit al dat ijzer zou je wel drie planeten kunnen maken met de omvang van Mars.
IJzer komt voor in het menselijk lichaam. Bloed bevat hemoglobine, een ijzer(II)complex dat voor de zuurstof/koolstofdioxide-uitwisseling zorgt. Het aandeel van ijzer is ongeveer 0,006%, dat is gemiddeld zo’n 3,6 gram per mens.
IJzer is aanwezig in een groot aantal mineralen, verspreid over de gehele wereld. Het komt voor in de vorm van oxiden, sulfiden, carbonaten, nitraten en silicaten.

De belangrijkste ijzerhoudende mineralen zijn:
| Ilmeniet (foto) | FeTiO3 |
| Hematiet, roodijzersteen of ijzerglans | Fe2O3 |
| Lepidokrokiet | gamma-Fe+3O(OH) |
| Limoniet of bruinijzersteen | FeO(OH).nH2O |
| Magnetiet of magneetijzersteen | Fe+2.Fe2+3O4 |
| Pyriet | FeS2 |
| Sideriet of ijzerspaat | FeCO3 |
Metallisch ijzer (in ‘gedegen’ toestand) komt slechts zeer sporadisch voor, onder andere in Groenland. De Hoba meteoriet in Namibië is ’s werelds grootste brok natuurlijk voorkomend ijzer, met een gewicht van meer dan zestig ton. Het is ook meteen de grootste meteoriet die we kennen. De samenstelling is 82-83% ijzer, 16-17 % nikkel, ongeveer 1% kobalt, en kleine sporen van diverse andere elementen.
Winning
De belangrijkste wingebieden voor ijzer liggen in China, Brazilië, Rusland, West-Australië, de Verenigde Staten van Amerika, India, Canada, Zuid-Afrika en Zweden. Kleinere wingebieden liggen in Frankrijk, Mexico, het Verenigd Koninkrijk, Duitsland, Spanje, Noorwegen, Finland en Venezuela. De EU heeft met de Critical Raw Materials Act in 2022 het element ijzer op de lijst van schaarse en strategische grondstoffen gezet.

Bereiding
Bereiding
Vroeger
De Hittieten, een volk dat zich ongeveer vanaf 2000 v. Chr. ontwikkelde in de regio Asia Minor (Anatolië, het huidige Turkije) waren waarschijnlijk de eersten die ijzer uit erts wisten te bereiden met behulp van houtskool. Zij hielden dit proces om strategische redenen – de productie van zwaarden en schilden – geheim. Na de val van hun rijk (rond 1200 v. Chr.) kwam deze ontdekking beschikbaar voor andere volkeren, wat leidde tot het ijzertijdperk. Ongeveer 800 v. Chr. begint de winning van erts en bereiding van ijzer in Europa (Balkan en Oostenrijk).
Het allereerste staal werd bereid door reductie van ijzererts met houtskool in een oven. Het werd daarbij niet vloeibaar. Alleen via langdurig smeden was het mogelijk ingesloten oxides en andere onzuiverheden te verwijderen. Later wist men (onder andere door voorverwarmen van de blaaswind) de procestemperatuur op te voeren zodat het ijzer meer koolstof opnam. Daardoor daalde het smeltpunt, maar het ijzer werd bros en nauwelijks smeedbaar. Het verbranden van het koolstof in het ijzer leidde uiteindelijk tot een staalsoort die wel smeedbaar was, maar nog veel onzuiverheden bevatte.
Tegenwoordig
IJzer (staal) wordt bereid via reductie van ijzererts met cokes in een hoogoven:
Dit proces verloopt via een aantal tussenstappen, die afhankelijk zijn van de temperatuur. Van boven (het koudere gedeelte van de hoogoven, tussen 200 en 700 °C) naar beneden (met veel hogere temperaturen, tot 1200 °C) vinden verschillende reacties plaats, zoals:
.
.

Het gevormde ijzer is vloeibaar. Tevens ontstaat een zogenoemde slak, waarin een aantal verontreinigingen (zoals SiO2, MnO, P2O5) wordt opgenomen. De slak drijft op het gesmolten ijzer en kan daardoor gemakkelijk worden verwijderd. Deze slak moet vloeibaar blijven. Indien nodig wordt vloeispaat (CaF2) toegevoegd om dit te bevorderen. Voor een goede slakvorming wordt calciumcarbonaat toegevoegd, dat ontleedt in calciumoxide en koolstofdioxide. Het koolstofdioxide reageert met cokes tot koolstofmonoxide, dat werkt als reductor. Het calciumoxide reageert met allerlei verontreinigingen, bijvoorbeeld met siliciumdioxide:
Van de laatste stof wordt hoogovencement gemaakt.
Het product van de hoogoven is ruwijzer. Als dit nog teveel verontreinigingen bevat (bijvoorbeeld teveel fosfor-, silicium-, of zwavelverbindingen of koolstof) kan het verder worden bewerkt. De niet gewenste bestanddelen worden geoxideerd, waarna de oxiden in de slak terechtkomen. Op deze manier wordt staal gemaakt met de gewenste samenstelling. Dit gebeurt op verschillende manieren, bijvoorbeeld via het oxystaalproces, waarbij men zuivere zuurstof gebruikt om het koolstofgehalte te verlagen. Een andere mogelijkheid is het Bessemer- en het Thomasproces. Hierbij wordt lucht door het ruwijzer geblazen en schroot toegevoegd om de temperatuur te beheersen. Een derde manier is het Siemens-Martinproces. Dit proces vindt plaats in een oven waarvan de temperatuur zeer goed regelbaar is. Daardoor kan meer schroot of vast ruwijzer worden verwerkt. Omdat de samenstelling van het staal zeer nauwkeurig is te regelen, wordt deze methode meestal gebruikt voor de vervaardiging van speciale staalsoorten.
De naam van het product is afhankelijk van het koolstofgehalte. Men spreekt van smeedijzer als het gehalte lager is dan 0,05 %; van zacht, hard en extra hard staal tussen 0,05 % en 2 % en van gietijzer boven de 2 %.
Staal bevat altijd (kleine hoeveelheden van) andere metalen. Zij worden niet aangeduid als de hoeveelheid beneden een bepaalde waarde blijft (bijv. aluminium< 0,1 %, nikkel, chroom < 0,3 %, mangaan < 1,6 %). Men noemt dat zelfs ongelegeerd staal.

Bij het stollen van het ijzer kan de aanwezige koolstof zich met zuurstof verbinden tot koolstofmonoxide. Door het gevormde gas komt het vloeibare ijzer in heftige beweging. Aan de buitenzijde ontstaat dan een laag zuiver staal, terwijl verontreinigingen in het midden van het blok staal terechtkomen. Dit ‘onrustige staal’ wordt voornamelijk gebruikt voor het maken van dunne platen (onder andere voor de auto industrie). Als de zuurstof gebonden wordt door toevoeging van aluminium en/of silicium, ontstaat half rustig of rustig staal. Dit wordt gebruikt voor zogenoemd constructiestaal (een staalsoort die zeer geschikt is voor bewerkingen als lassen, branden, enz.), omdat de eigenschappen van het materiaal wat gelijkmatiger zijn.
Staalsoorten worden veelal ingedeeld op verwerkingsmethode of toepassingsgebied, bijvoorbeeld: gietstaal, transformatorplaat, verenstaal, klinknagelstaal, sneldraaistaal, rollagerstaal, hittevast staal, niet magnetiseerbaar staal, enz.
Staal oxideert snel. Het wordt hiertegen beschermd door verzinken, aluminiseren of cadmeren. Ook kan men zwak legeren om atmosferische corrosie tegen te gaan. Er wordt dan zogenoemd weer vast staal gevormd, dat weliswaar wordt bedekt door een roestlaag (oxidelaag), maar één die vrijwel ondoordringbaar is en dus bescherming biedt. Door staal te legeren met grotere hoeveelheden chroom en/of nikkel verkrijgt men roestvrij of roestvast staal. Het meest gebruikte roestvrije staal is RVS 18-8. Dit staal is gelegeerd met 18 % chroom en 8 % nikkel. Het is zelfs roestvast in aanwezigheid van chloride-ionen en wordt daarom veel in zee atmosfeer toegepast. Om de roestvaste eigenschappen te verhogen wordt zo nodig (tot 2%) molybdeen toegevoegd. In de handel vindt men eveneens voorgelakte staalplaat of staal voorzien van een laagje kunststof of rubber.

Legeringen
De technische eigenschappen van ijzer zijn aanzienlijk te verbeteren via legeren – het toevoegen van andere metalen. De reeks van mogelijke legeringselementen is zeer uitgebreid; de belangrijkste zijn aluminium, chroom, mangaan, molybdeen, nikkel, titaan, vanadium, kobalt, wolfraam, niobium en tantaal. De beoogde toepassing bepaalt aan welke eigenschappen het staal moet voldoen en dus welke legeringselementen in de ‘staalreceptuur’ worden opgenomen.
Hoewel het toevoegen van een legeringsmetaal altijd van invloed is op meerdere eigenschappen, wordt in onderstaande tabel het belangrijkste effect weergegeven.
| Stof | Toegevoegd om |
|---|---|
| Al | In het staal aanwezige zuurstof te binden |
| B | De treksterkte te verhogen (omdat dit metaal neutronen absorbeert, wordt aan staal voor de bouw van kernreactoren 1 % boor toegevoegd) |
| C | De sterkte en de hardbaarheid te verbeteren |
| Ce | De vuurvastheid en de sterkte bij hogere temperatuur te bevorderen |
| Co | De sterkte en de snijbaarheid te verhogen en corrosie tegen te gaan |
| Cr | De slijtvastheid en de snijbaarheid te verbeteren (wanneer 13 % of meer chroom wordt toegevoegd, ontstaat roestvrij staal) |
| Mn | De sterkte en de lasbaarheid te verbeteren |
| Mo | De treksterkte en de lasbaarheid te verhogen en putcorrosie bij chroom-nikkel-staal te voorkomen |
| Nb, Ta | De sterkte bij hogere temperatuur te verhogen (wordt toegepast in hittevast staal) |
| Ni | Corrosie te voorkomen. |
| Si | De elastische eigenschappen te verbeteren |
| Ti | De sterkte bij hoge temperatuur en de magnetische eigenschappen te verhogen |
| V, W | De verspaanbaarheid en de elastische eigenschappen te verhogen |
| Zr | Oxidatie tegen te gaan; het verlengt de levensduur van bijvoorbeeld verwarmingselementen |
Zuiver ijzer wordt op verschillende manieren verkregen:
- Door reductie van het zuivere oxide of hydroxide met waterstof
- Door elektrolyse
- Door verhitting van onzuiver ijzer met koolstofmonoxide. Dit resulteert in de vorming van Fe(CO)5, dat bij ontleden zuiver ijzer oplevert .