Het harde, zilvergrijze overgangsmetaal kobalt heeft een sprookjesachtige naam, maar niet in de positieve betekenis. De naam is afgeleid van het Germaanse ‘kobold’ voor aardmannetje of kwaadaardige kabouter. De kobolden kregen de schuld van de moeilijke winning van het metaal (in tegenstelling tot bijvoorbeeld koper of zilver). Kobalt is magnetiseerbaar, net als ijzer, en wordt dus gebruikt voor magneten. Het is ook een populair legeringselement voor ijzer, omdat het de hardheid en temperatuurbestendigheid positief beïnvloedt. Het radioactieve isotoop kobalt-60 is een sterke gammastraler die onder andere wordt toegepast voor de bestraling van tumoren en de sterilisatie van instrumenten en van voedsel. Kobalt is een essentieel element voor mensen, het komt voor in vitamine B12.
Symbool
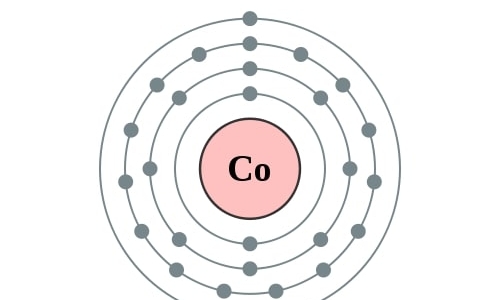
Co
Protonen/elektronen
Groep
Isotopen
59Co
Periode
4
Elektronenconfiguratie
[Ar] 4s2 3d7
Blok
d
Elektronencofiguratie Bohr
2,8,15,2
Bij kamertemperatuur
vast
Elektronegativiteit
1,7 (Pauling)
Dichtheid
8860 kg m-3
Atoomstraal
125 . 10-12 m
Smeltpunt
1495 oC (1768 K)
Relatieve atoommassa
58.9332
Kookpunt
2927 oC (3200 K)
Soortelijke warmte
420 J kg-1K-1
Warmtegeleidingscoëfficiënt
70 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Veiligheidsscheermes, reactoren en motoren.
De bekende scheermesjes bestaan vaak uit kobaltstaal (40-60 % kobalt, met chroom, wolfraam en koolstof) of stelliet (50-60 % kobalt, 30-40 % chroom, 8-20 % wolfraam) vanwege de grote slijtvastheid en hoge corrosiebestendigheid. Stelliet is een veel toegepaste kobaltlegering die onder andere te vinden is in de beitelpunt van boorwerktuigen, reactoren in de chemische industrie, chirurgische instrumenten en in de motoren en turbines van straalvliegtuigen, schepen, racemotoren en gasturbines.
Permanente magneet
Een aantal kobaltlegeringen hebben zeer goede magnetische eigenschappen. Zo is een magneet gemaakt van de legering Alnico 25 maal krachtiger dan een gewone staalmagneet. Alnico is een legering van aluminium, kobalt en nikkel (AlNiCo).

Ook Co5Sm heeft ongewone magnetische eigenschappen. Het geldt voor alle verbindingen Co5Z, Co7Z2, Co17Z2, waarin Z een zeldzaam aardmetaal voorstelt.
Katalysator uitlaatgas
Kobaltoxide (Co3O4) in de uitlaatkatalysator van auto’s helpt bij de volledige verbranding van koolmonoxide:
Kobaltmolybdeensulfide (op aluminiumoxide als drager) katalyseert de reactie:
Pigment
Kobaltblauw (kobaltaluminaat, CoAl2O4) is een veelgebruikte pigmentstof om een blauwe kleur te geven aan email, porselein, glas en verf. Het is ook te vinden in het blauw van bankbiljetten. Kobaltblauw heeft allerlei namen, zoals Thénard’s blauw. Het is een helder blauwe verfstof, zeer lichtvast en goed bestand tegen hoge temperaturen en tegen aantasting door zuren en basen. Ook het bekende “Delfts blauw” bevat kobaltverbindingen als pigment.

Weerprofeet
Bij een aantal kobalt(II)zouten treedt verkleuring op als ze kristalwater opnemen. Zo is droog kobalt(II)chloride blauw, maar met kristalwater is het roze tot rood. Dit hydratatieproces is omkeerbaar zodat de kleur van het zout afhankelijk is van de luchtvochtigheid van de omgeving. Zo’n ‘weerprofeet’ is dus blauw bij mooi weer blauw en roze bij vochtig weer.
Gammabestralingsbron
Het radioactieve isotoop 60Co is een krachtige gammastraler met een halfwaardetijd van 5,3 jaar. Het is veel goedkoper dan radium, veroorzaakt minder ernstige beschadigingen van de huid en heeft weinig schadelijke bijwerkingen. In 1951 vond de eerste bestraling met kobalt-60 plaats in een Canadees ziekenhuis. Het isotoop wordt verder gebruikt voor de sterilisatie van instrumenten, de conservering van voedsel en als ‘merkstof’ in de biologie, de industrie en de chemie.

Meer toepassingen
Als element en in legeringen
- Beschermlaag voor metalen
- Bot- en tandprothese (64 % Co, 30 % Cr, 5 % Mo)
- Elektrische weerstandsdraad (Co, Fe, Cr, Al)
- Slijpschijven voor diamanten
- Horlogeveer (40 % Co + Cr, Ni, Mo, Mn, C, B)
In verbindingen
| Gasmaskerabsorbens voor NH3 en gifgassen | CoCl2 |
| Haarverf | Co(NO3)2 |
| Inkt voor geheimschrift | CoCl2 |
| Katalysator bij ontzwaveling (COMOX) | Co3O4 + MoO3 |
| Katalysator bij polymerisatie van kunststof (PET) | div. Co-verb. |
| Onzichtbare inkt | CoCl2 |
| Oplaadbare batterijen (betere elektrochemische eigenschappen) | Co(OH)2, LiCoO2 |
| Schuimvormer/stabilisator voor bier | CoCl2 |
| Veevoederadditief (voor vitamine B-12 productie) | CoCl2, CoSO4 |
| Zonnecollectoren | Co3O4 |
Naam & ontdekking
Naam
De naam kobalt is afgeleid van Kobold, de Oud Germaanse (berg)geest. In vroeger tijden werd de lastige winning van het metaal toegeschreven aan tegenwerking van de Kobolden. Kobaltertsen zien er net zo uit als koper- of zilverertsen, maar met de primitieve methoden was het niet mogelijk er metaal uit te isoleren. Later verbasterde de naam tot kobalt, wat in het Latijn cobaltum werd.

Ontdekking
De Egyptenaren, Grieken en Romeinen gebruikten al in de oudheid verbindingen met kobalt, vooral om glas blauw te kleuren. In Perzië is een halssnoer met blauwe glaskralen gevonden uit 2250 v. Chr. Ook de Chinezen gebruikten kobalt verbindingen. Ze kleurden er hun beroemde porselein mee, onder andere ten tijde van de Tang en Ming-dynastieën (respectievelijk 7-10e en 14-17e eeuw).
Kobalt is het eerste metaal waarvan de ontdekking echt aan iemand is toe te schrijven. Eerdere metalen (ijzer, koper, zilver, goud, zink, kwik, tin, lood en bismuth) waren al sinds mensenheugenis bekend en hadden geen bekende ontdekkers.

De ontdekker van kobalt is de Zweedse chemicus Georg Brandt. Die stelde in 1735 vast dat een nieuw element verantwoordelijk moest zijn voor de blauwe kleuring, en niet bismuth, zoals lang werd gedacht. In 1780 wist de Zweedse chemicus/mineraloog Torbern Olof Bergman (foto) het eerste metallisch kobalt te isoleren.
In 1938 ontdekten de Amerikaanse radiochemici John Livingood en Glenn T. Seaborg het isotoop kobalt-60, dat (onder andere) veel wordt gebruikt voor de bestraling van tumoren.
Voorkomen
Voorkomen
Kobalt staat op de dertigste plaats in de lijst van meest voorkomende elementen, met een aandeel van 0,0025% in het gewicht van de aardkost.
Kobalt is ook een essentieel mineraal voor mensen, het is bijvoorbeeld onderdeel van vitamine B12. Toch is het in ons lichaam één van de minst voorkomende elementen. Een menselijk lichaam bevat ongeveer 1 mg kobalt.

Kobalt wordt in allerlei mineralen aangetroffen. De belangrijkste zijn:
| Carrolliet | Cu(Co,Ni)2S4 |
| Erythrien of kobaltbloed | Co3(AsO4)2.8H2O |
| Heterogeniet | CoO(OH) |
| Kobaltiet of kobaltglans | CoAsS |
| Linnaeïet of kobaltkies | Co3S4 |
| Saffloriet | (Co,Fe)As2 |
| Sferokobaltien | CoCO3 |
| Skutterudiet of smaltien | Skutterudiet of smaltien CoAs2-3 |
Ook mangaanknollen bevatten kobalt, tot ruim 2 % – zowel in de aarde als op de zeebodem. Verder is het te vinden in nikkelertsen zoals kobaltnikkelkies of siegeniet ((Co,Ni)3S4) en in koperertsen zoals carroliet ((Cu,Co)2S4).
Men neemt aan dat in het binnenste van de aarde het kobaltgehalte veel hoger is dan in de aardkorst (ruwweg de buitenste 16 km), aangezien materiaal afkomstig van meteorieten veel meer kobalt bevat (0,5 – 2,5 %) dan de aardkorst.
Winning
De belangrijkste wingebieden liggen in de Democratische Republiek Congo (Katanga), Zambia, de Verenigde Staten van Amerika, Cuba, Nieuw Caledonië, Australië, Canada (Ontario), Rusland (Kaukasus), Finland, Zweden, Noorwegen, Marokko, Burma, Zimbabwe, Indonesië en Japan. De EU heeft met de Critical Raw Materials Act in 2022 het element kobalt op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
Vroeger werd kobalt bereid door kobalt houdende ertsen reduceren met houtskool.

Tegenwoordig
Veel kobalt wordt gewonnen als ‘bijproduct’ bij de winning van nikkel of andere metalen zoals koper, ijzer en zilver. Er zijn verscheidene productieprocessen, bijvoorbeeld:
Door ‘roosten’ (verhitten) en een behandeling met soda en salpeterzuur ontstaan oxides, waaruit door reductie een legering van de aanwezige metalen ontstaat. Bij behandeling van deze legering met 20 % zwavelzuur lossen ijzer en kobalt op. Eventueel aanwezig koper is door elektrolyse te verwijderen. Vervolgens wordt eerst het ijzer verwijderd door een behandeling met natriumchloraat (NaClO3) en natriumcarbonaat (Na2CO3). Daarna leidt het toevoegen van chloorkalk tot het neerslaan van kobalthydroxide, dat tenslotte met cokes wordt gereduceerd tot het metaal.
Ook wordt kobalt verkregen door elektrolyse van uitgeloogde ertsen of door het oplossen van kobaltverbindingen in ammoniak (NH3), gevolgd door reductie met waterstof.