Koolstof is aanwezig in gesteenten, als carbonaatzouten van calcium, magnesium en ijzer. Als CO2 komt het voor in de atmosfeer en opgelost in oppervlaktewater. Fossiele brandstoffen zoals kolen, olie en aardgas bestaan grotendeels uit koolwaterstoffen. Koolstof kan een enorme variëteit aan verbindingen vormen; het zit in 80% van alle bekende moleculen. Het menselijk lichaam bestaat voor 23% uit koolstof. In zuivere vorm komt het in de natuur voor als amorf koolstof, grafiet en diamant. Grafiet is een van de zachtste materialen; diamant een van de hardste. Onderzoek heeft nieuwe verschijningsvormen opgeleverd: buckyballen, nanobuisjes en grafeen.
Symbool
C
Protonen/elektronen
Groep
Isotopen
12C, 13C
Periode
2
Elektronenconfiguratie
[He] 2s2 2p2
Blok
p
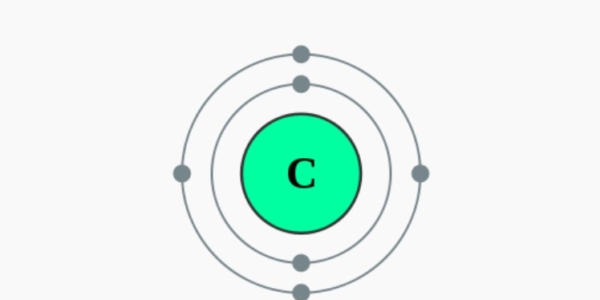
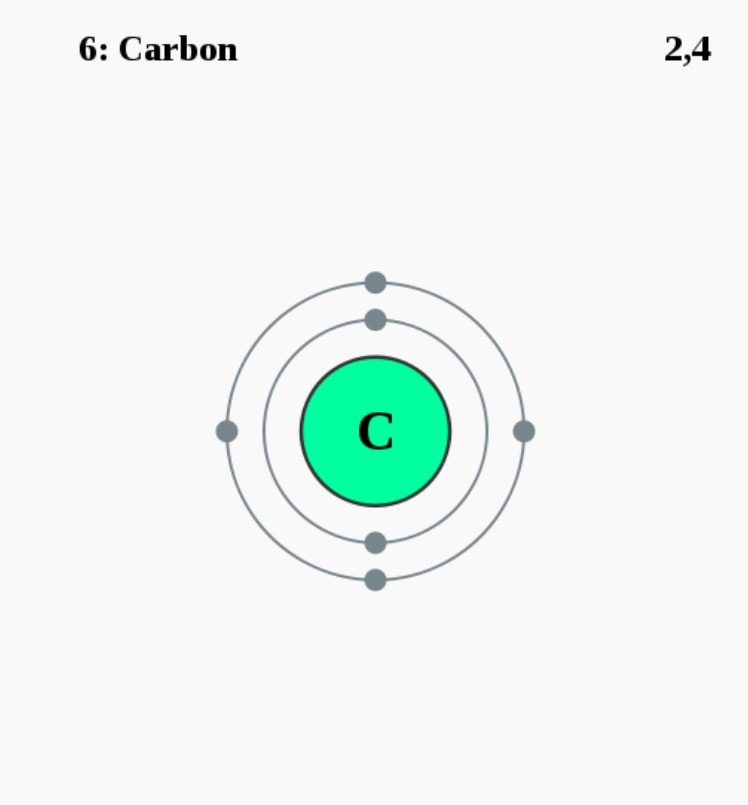
Elektronencofiguratie Bohr
2,4
Bij kamertemperatuur
vast
Elektronegativiteit
2,5 (Pauling)
Dichtheid
2100 kg m-3 (grafiet)
3513 kg m-3 (diamant)
Atoomstraal
77 . 10-12 m
Smeltpunt
3550 oC (3823 K)
Relatieve atoommassa
12.01115
Kookpunt
3825 oC (4098 K)
Soortelijke warmte
850 J kg-1K-1
Warmtegeleidingscoëfficiënt
160 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Water- en luchtzuivering
Als actieve kool speelt koolstof een grote rol bij de zuivering van water en lucht. Het betreft uiterst fijne koolstofdeeltjes die een zeer groot specifiek oppervlak hebben, tot wel 2000 vierkante meter per gram koolstof. Actieve kool heeft een bijzonder grote adsorberende werking en om die reden wordt het op grote schaal toegepast. Het is te vinden in uiteenlopende toepassingen als waterfilters, gasmaskers en installaties voor de zuivering van voedingsmiddelen en van chemische en farmaceutische producten. In de vorm van de bekende zwarte tabletten is actieve kool geschikt voor maagzuivering.

Roet in autobanden
Roet, gevormd door onvolledige verbranding van koolwaterstoffen, bestaat uit koolstofdeeltjes met een grootte van ongeveer 20 tot 300 nanometer. Als toevoeging aan het rubber van autobanden zorgt het voor een vergroting van de slijtvastheid en de stevigheid. Per autoband wordt wel 3 kg roet toegevoegd; de productie van roet bedraagt dan ook vele miljoenen tonnen per jaar. Het is ook te vinden in andere rubberproducten zoals drijfriemen en afdichtingsringen.
Staal en gietijzer
Koolstof is een belangrijk legeringselement voor ijzer. Het vergroot de sterkte en de hardheid. Gietijzer bevat doorgaans enkele procenten koolstof. Bij een aandeel van minder dan twee procent koolstof spreekt men van staal.
Diamant
Diamant is koolstof met een tetraëdrische kristalstructuur. Vanwege de hoge hardheid wordt het toegepast in boorkoppen, bijvoorbeeld voor aardoliewinning en tunnelbouw. Je vindt ook diamanten in allerlei soorten snijapparatuur zoals glassnijders en steenzagen. Het zijn geen geslepen diamanten zoals in sieraden, maar minuscule diamantsteentjes – een soort ‘diamantgruis’. Het gaat ook lang niet altijd om natuurlijke diamanten. Er zijn verschillende processen ontwikkeld om synthetisch diamant te produceren voor industriële toepassing.

De zeer hoge brekingsindex van diamant heeft het materiaal tot “a girl’s best friend” gemaakt. Als een vakman een ruwe diamant goed heeft geslepen, dan weerkaatst het invallende licht vele malen binnen in de diamant voordat het op de geslepen vlakken uittreedt. Hierdoor ontstaat de bijzondere schittering die diamant zo aantrekkelijk maakt voor sieraden.
Ook voor deze toepassing is “namaakdiamant” beschikbaar. Uit koolstof en silicium is een zeer hard kristal te bereiden dat net als diamant te slijpen is. Het heeft een iets diepere glans dan diamant, is iets minder hard en bovenal vele malen goedkoper. Het wordt wel Moissanniet genoemd, naar de Franse scheikundige en Nobelprijswinnaar Ferdinand Frederick Henri Moissan (1852 – 1907). Die ontdekte de siliciumkoolstofkristallen in 1893 bij materiaalonderzoek aan fragmenten van de Canyon Diablo Meteorite in Arizona (USA).

Grafiet: potloden, smeermiddelen en koolborstels
De dunne zwarte stift aan de binnenzijde van potloden bestaat uit grafiet. Van de gelaagde koolstofstructuur van het grafiet breken bij het schrijven dunne, microscopische schilfers af, die zich aan het papier hechten.
Grafiet wordt vanwege de schilferende eigenschap ook toegepast in smeervetten en smeermiddelen voor industrieel gebruik. De bekende kruipolie voor thuisgebruik bevat grafiet. Vanwege de elektrische geleiding wordt grafiet gebruikt als contactmateriaal bij bewegende onderdelen (koolborstels).

Grafeen
In 2004 maakten de Russisch/Nederlandse natuurkundige Andre Konstantinovitsj Geim (1958) samen met zijn promovendus Konstantin Sergejevitsj (1974) grafeen, een nieuwe verschijningsvorm van koolstof. Ze haalden met behulp van plakband een dun laagje van grafiet af en herhaalden dit tot het laagje nog slechts één atoomlaag dun was. Onder de de elektronenmicroscoop bleek dat ze daarmee grafeen in hadden gekregen: een moleculair soort kippengaas met de dikte van één koolstofatoom. Grafeen is een sterk materiaal met bijzondere elektrische en optische eigenschappen. Het onderzoek aan dit unieke materiaal heeft sinds 2004 een hoge vlucht genomen en er wordt veel van verwacht op uiteenlopende gebieden, van elektronica tot sensortechnologie en zonnecellen.

Benzine, olie, aardgas
Alle fossiele brandstoffen zoals kolen, aardolie en aardgas zijn gevormd uit plantaardig materiaal en bevatten koolstof of koolwaterstoffen. Van aardolie worden door destillatie of door kraken en destillatie diverse aardolieproducten verkregen, zoals benzine, kerosine, dieselolie, smeerolie, paraffine en asfalt. Tevens worden uit aardolie veel (half)producten gemaakt voor de chemische en farmaceutische industrie.
Kunststoffen
Je zou kunnen zeggen dat we vandaag de dag in het kunststof tijdperk leven: kunststoffen (ook plastics genoemd) zijn niet meer weg te denken uit onze samenleving. Eerst werden ze ontwikkeld als vervanger van bestaande materialen. Inmiddels zijn kunststoffen beschikbaar met unieke combinaties van eigenschappen. Ze maken constructies en productvormen mogelijk die met geen enkel metaal of andere materialen te realiseren zijn. De technologische vooruitgang op gebieden als de lucht- en ruimtevaart, de auto-industrie, de sport, de geneeskunde en de informatietechnologie zou zonder deze nieuwe materialen onmogelijk zijn geweest.

Kunststoffen zijn opgebouwd uit lange en soms ook vertakte molecuulketens, de polymeren. In vrijwel alle gevallen is koolstof in deze ketens het overheersende element. De belangrijkste grondstoffen voor kunststof (de monomeren) zijn kleine koolwaterstofmoleculen verkregen uit de verwerking van aardolie.
Kunstvezels, synthetisch textiel
Kunstvezels zijn kunststoffen die tot draden zijn gesponnen. Daarmee zijn op dezelfde manier als natuurlijke vezels (wol en katoen) textielproducten te maken. Denk aan kleding, gordijnen en vloerbedekking. Vaak worden synthetische vezels samen met natuurlijke vezels verwerkt om optimale product eigenschappen te krijgen.
Een aantal belangrijke vezels zijn:
- Nylon – wordt toegepast in sokken, kousen, panty’s, lingerie, sport- en badkleding, gordijnen, meubelbekleding, tapijt, skikleding, regenkleding en veiligheidsgordels.
- Polyetheentereftalaat (PET) – is te vinden in kostuums, rokken, vitrages, ski-jacks, aandrijfriemen, zeildoek, gordijnen, veloursstoffen en overhemden.
- Polyacrylonitril (PAN of gewoonweg acryl) – vind je in vesten, truien, sokken, imitatie-bont, zonwering, gordijnen, dekens, stof voor tuinstoelen en tafelkleden.

Ook de kunststoffen polyvinylchloride (PVC) en polyetheen (PE) zijn tot vezel te verwerken en kunnen dan gebruikt worden voor bijvoorbeeld autobekleding, dekzeilen, gordijnstoffen, (isolerende)kleding, waterdichte visserskleding, tapijt, visnetten en touw.
Supersterke vezels
Supersterke vezels zijn kunststofvezels die pas bij een zeer hoge belasting breken. Ze zijn vele malen sterker en vele malen lichter dan staal. De supereigenschappen ontstaan door de polymeermoleculen zo ‘op te rekken’ dat ze zoveel mogelijk parallel lopen. Hierdoor nemen de onderlinge krachten tussen de moleculen (de vanderWaalskrachten) sterk toe. Bekende supervezels zijn Kevlar® (van DuPont de Nemours), Twaron® (ontwikkeld door AkzoNobel, nu van Teijin Aramid) en Dyneema® (van DSM). Deze vezels zijn gebaseerd op koolstofhoudende polymeren.

De vezels zijn te vinden
- in kabels en touwen, vislijnen en -netten
- in beschermende kleding, zoals snijbestendige handschoenen, kogelwerende vesten, bepantsering voor o.a. politieauto’s, beenbeschermers voor shorttrackschaatsers, enz.
- ter versterking van autobanden, in remvoeringen, koppelingsplaten, en afdichtingsringen
- voor lichte, zeer stevige constructies, o.a. in vliegtuigbouw en ruimtevaart (als zogenoemde composieten: gecombineerd met andere materialen, waarbij de vezel dient ter versterking van de andere materialen)
- in de sport: voor de bouw van zeer lichte jachten, zeilen, ski’s, vishengels, tennisrackets, kleding en handschoenen bij het schermen, enz.
Koolstofvezels
Vezels van uitsluitend koolstof zijn in feite de eerste supersterke vezels. Ze worden gemaakt door polymeervezels (meestal polyacrylonitril) bij zeer hoge temperatuur (tot 2000 ºC) te graffitiseren, waarbij onderling verbonden koolstofketens ontstaan. Koolstofvezels dienen vooral ter versterking van andere kunststoffen. De vezelversterkte kunststoffen worden ook wel composieten genoemd. Ze maken producten mogelijk die licht, maar toch sterk en buigzaam zijn. Zoal voor in de lucht- en ruimtevaart en in lichte, sterke carrosserieonderdelen bij racemotoren en formule-1-auto’s. Ook in sporten waar vermindering van het gewicht van groot belang is, vinden koolstofvezels toepassing. Denk aan ski’s, tennisrackets, golfclubs en racefietsen.

Meer toepassingen
Als element
- Booglampen
- Elektrische contacten
- Elektrodemateriaal
- Kleurstof voedingsmiddelen (E153)
- Moderator in kernreactoren
- Cokes in hoogovens (ijzerproductie)
- Pigment inkt, verf, papier, kunststoffen, beton, keramiek
- Sigarettenfilter
- Toner voor kopieerapparatuur en laserprinter
In verbindingen
| Alle organische verbindingen bevatten koolstof | Vetten, eiwitten, koolhydraten, alcoholen etc. |
| Bevorderen van de plantengroei in de tuinbouw (in kassen) | CO2 |
| Coating voor boor-, snij- en slijpgereedschap | NbC |
| Corrosiebestendig materiaal | Cr3C2 en Cr23C6 |
| Drijfgas | CO2 |
| Gereedschap, boor- en snijapparatuur | TiC |
| Lasers voor chirurgische toepassingen, bijv. snijinstrument | CO2 |
| Ouderdomsbepaling | 14C-verbindingen |
| Polijstmateriaal | TaC |
| Porselein | B4C |
| Vulkaniseren van rubber | CS2 |
| Vulling brandblussers | CO2 |
| Bluspoeder | KHCO3 |
| Vulstof in papier, cosmetica en zeep | MgCO3 |
| Zeepbereiding | K2CO3 |
Naam & ontdekking
Naam
De Latijnse naam voor koolstof, carbonium, is afgeleid van carbo, dat steenkool betekent. De naam koolstof duidt op de herkomst van het element: materiaal (stof) aanwezig in steenkolen.

De naam grafiet is afkomstig van het Griekse woord voor schrijven: graphein. Diamant is een samentrekking van de Griekse woorden diaphanes en adamas, respectievelijk transparant en onoverwinnelijk – dat laatste vanwege de hardheid.
Ontdekking
Koolstof was reeds in de Oudheid bekend. Het was onmisbaar bij de productie van onder andere ijzer en zilver. Waarschijnlijk werd daarbij aanvankelijk natuurlijk voorkomend grafiet toegepast. Later wist men koolstof te verkrijgen via de productie van houtskool.
De Zweeds-Duitse chemicus Carl Wilhelm Scheele stelde in 1779 vast dat grafiet een vorm van koolstof was. De Engelsman Smithson Tennant en de Fransman Antoine Lavoisier toonden dit in 1796 aan voor diamant.
Voorkomen
Voorkomen
Koolstof is redelijk overvloedig aanwezig in het heelal. Het is na waterstof, helium en zuurstof het meest voorkomende element. Het is aangetoond in de zon en vele sterren.
In de aardkorst is koolstof het 17e meest voorkomende element. Het aandeel is 0,02% op basis van gewicht. In de oceanen staat koolstof met een gewichtspercentage van 0,0028% op de 10e plaats. In het oceaanwater is vooral veel koolstofdioxide opgelost: ongeveer 50 maal de hoeveelheid die in de atmosfeer aanwezig is.
Koolstof is vooral hét element van de biosfeer (het gedeelte van de aarde waar leven mogelijk is). Het komt voor in alle levende organismen en in alle organische stoffen, zoals koolwaterstoffen, koolhydraten, vetten, eiwitten. Het is goed voor 23% van het totale gewicht van het menselijk lichaam en staat daarmee op de tweede plaats, na zuurstof (63%).
Elementair koolstof is uit de aarde te winnen als grafiet en diamant. Verder zit koolstof vooral in steenkool, aardolie en aardgas, en in tal van mineralen. Een belangrijke groep zijn de carbonaten, met als belangrijkste
| cerussiet | PbCO3 |
| dolomiet (foto) | CaMg(CO3)2 |
| magnesiet | MgCO3 |
| marmer, krijt, calciet | CaCO3 |
| sferokobaltiet | CoCO3 |
| sideriet | FeCO3 |
| smithsoniet | ZnCO3 |
Winning
De belangrijkste wingebieden voor diamant liggen in Zuid-Afrika, de Verenigde Staten van Amerika, Rusland, Oekraïne, Polen, Democratische Republiek Kongo, India, Indonesië, Brazilië, Namibië, Tanzania en Australië.
De grootste voorraden van natuurlijk grafiet zijn te vinden in Mexico en China.
Wereldwijd wordt op heel veel plaatsen steenkool gewonnen in mijn- en dagbouw.
De EU heeft met de Critical Raw Materials Act in 2022 natuurlijke grafiet en steenkool op de lijst van schaarse en strategische grondstoffen gezet.

Bereiding
Bereiding
Vroeger
Koolstof werd vroeger gewonnen als natuurproduct (grafiet, kolen) en bereid door onvolledige verbranding van hout (houtskool), beenderen of bloed.
Tegenwoordig
Diamant
Diamanten zijn tegenwoordig synthetisch te bereiden. Het gaat daarbij meestal om kleine exemplaren van maximaal 1 karaat (1 karaat is 200 mg). Ter vergelijking: natuurlijke diamant komt normaal gesproken voor in stukken tot ca. 50 karaat. De grootste diamant, de Cullinan, is maar liefst 3106 karaat.

Synthetische diamant (foto: microscopische kristalletjes) is te maken door zeer zuiver grafiet samen te persen bij 1450 ºC en circa 60.000 bar (6*109 Pa). Bij een nieuwe methode wordt een mengsel van waterstofgas en een koolwaterstof (bijv. methaan of ethyn) tot zo’n 800 ºC verhit in vacuüm. Daarbij ontstaan waterstof- en koolstofradicalen en zet de koolstof zich in diamantvorm af op een substraat. Deze synthetische diamanten zijn kleurloos en nog harder dan natuurlijke diamant.
Grafiet
Grafiet is synthetisch te bereiden door koolstof (bijv. roet of cokes) met zand te verhitten, en daarna het gevormde siliciumcarbide thermisch te ontleden:
.
Zeer zuiver grafiet is te verkrijgen door natuurlijk grafiet te behandelen met mengsel van de sterke zuren waterstofchloride en waterstoffluoride (HCl/HF) en vervolgens te verhitten tot 1500 ºC.
Roet
Roet wordt gevormd door onvolledige verbranding van koolwaterstoffen.
Cokes
Cokes ontstaan door het ontgassen van steenkool. Ze dienen als één van de belangrijkste reductoren bij de winning van diverse metalen uit erts,
Andere vormen van koolstof
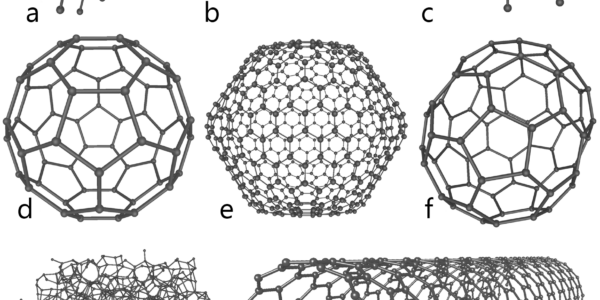
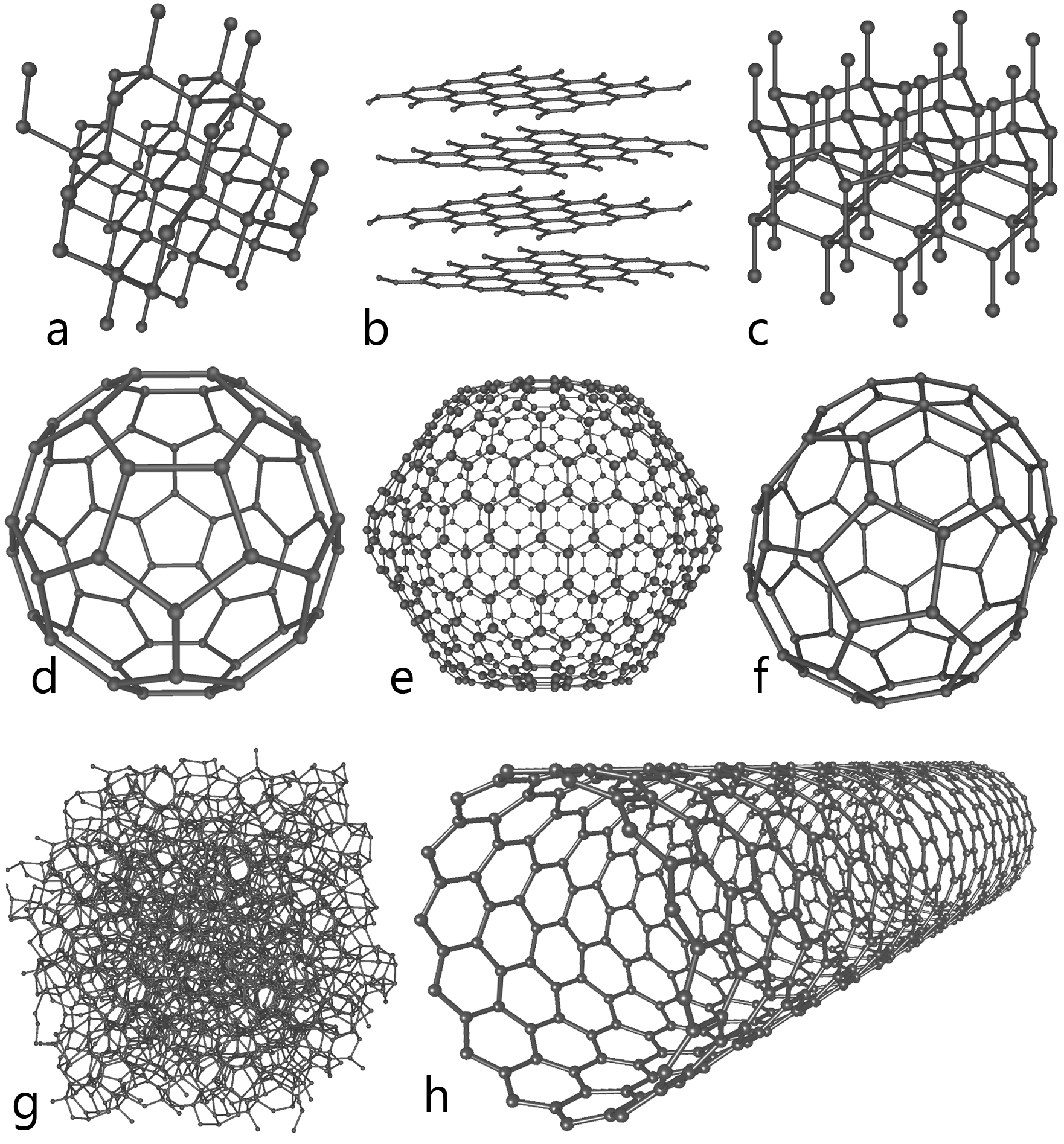
Sinds 1985 blijkt het mogelijk andere kristalvormen van koolstof te bereiden. De eerste vorm die kon worden gesynthetiseerd, bestaat uit moleculen met 60 koolstofatomen. De atomen zijn, in 12 vijfringen en 20 zesringen, gerangschikt in de vorm van een voetbal. Deze vorm – die inmiddels ook in de natuur is gezien – wordt (buckminster)fullereen genoemd, vaak afgekort tot buckyball.
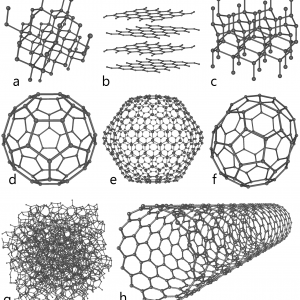
Daarna is men er in geslaagd allerlei andere vormen te maken: koolstof-nanotubes of buckytubes (C70) en “uien” (Cx met x>70). In de nanotuben komen zevenringen voor. Zowel nanotubes als uien kunnen “gevuld” worden met metalen of andere componenten.
Sinds 2004 blijkt nóg een vorm van koolstof relatief gemakkelijk in het laboratorium te verkrijgen: grafeen. Dat is een soort moleculair kippengaas met de dikte van één koolstofatoom. Grafeen heeft bijzondere elektrische en optische eigenschappen. Het werd voor het eerste verkregen door grafiet “af te pellen” met een stukje plakband. Inmiddels zijn in allerlei laboratoria alternatieve methoden ontwikkeld.