Van de meest alledaagse metalen heeft het dof grijze lood de hoogste dichtheid. Het is vooral te vinden in auto-accu’s en wordt ook toegepast in dakbedekkingen en als stralingsbeschermer. Veel uit vroeger tijden bekende toepassingen zijn inmiddels achterhaald vanwege de milieu- en gezondheidsaspecten. Lood is giftig en hoopt zich op in het lichaam. Kleine hoeveelheden lood(verbindingen) kunnen al de ontwikkeling en het functioneren van de hersenen beïnvloeden. De teloorgang van het Romeinse Rijk wordt (ten dele) aan het veelvuldig gebruik van lood toegeschreven.
Symbool
Pb
Protonen/elektronen
Groep
Isotopen
204Pb, 206Pb, 207Pb, 208Pb
Periode
6
Elektronenconfiguratie
[Xe] 4f145d106s26p2
Blok
p
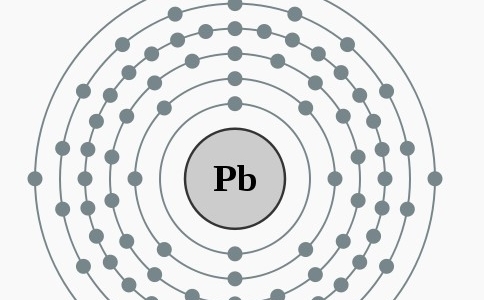
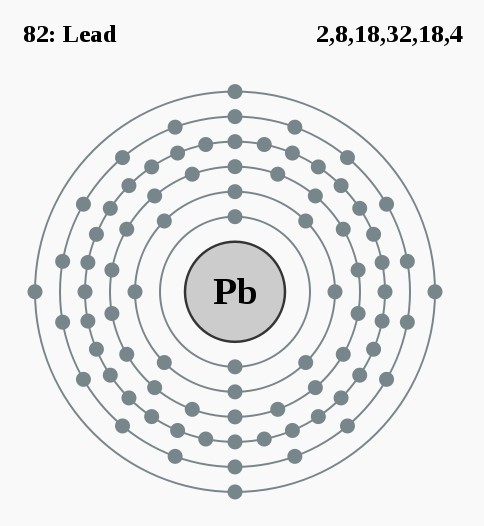
Elektronencofiguratie Bohr
2,8,18,32,18,4
Bij kamertemperatuur
vast
Elektronegativiteit
1,6 (Pauling)
Dichtheid
11300 kg m-3
Atoomstraal
175 . 10-12 m
Smeltpunt
328 oC (601 K)
Relatieve atoommassa
207.19
Kookpunt
1749 oC (2022 K)
Soortelijke warmte
128 J kg-1K-1
Warmtegeleidingscoëfficiënt
35.3 W m-1K-1
Selecteer
Toepassingen
Naam & ontdekking
Voorkomen
Bereiding
Beeld en audio
Toepassingen
Toepassingen
Accu
De belangrijkste toepassing van lood is de accu. Een accu is (net als een batterij), een elektrochemische cel die chemische energie omzet in elektrische energie. De loodaccu van traditionele auto’s verzorgt de ondersteunende elektriciteitsvoorziening, zoals het aandrijven van de startmotor. De accu’s van moderne elektrische en hybride auto’s leveren elektriciteit voor de aandrijving. Dit zijn meestal nikkel-metaal hydride of lithium-ion accu’s.
Een traditionele loodaccu bestaat uit een aantal cellen, die ieder een spanning van ongeveer 2 V leveren. Een serie geschakelde cellen levert zo een spanningsbron van de gewenste spanning (bijv. 6 of 12 V).

Elke cel is opgebouwd uit twee loodplaten waarvan er één bedekt is met een laag lood(IV)oxide. Als elektrolyt (stroomgeleider tussen de twee platen) dient verdund zwavelzuur (ca. 32 %). Bij stroomlevering in een loodaccu treden de volgende reacties op:
Deze reacties zijn omkeerbaar, zodat de accu ook weer met behulp van een uitwendige stroombron (dynamo) is op te laden. Daarbij wordt dus weer lood en lood(IV)oxide gevormd.
De hardheid en corrosiebestendigheid van de loodplaten in de accu is te vergroten door legering met antimoon (tot ca. 9%). Tegenwoordig gebruikt men ook calcium en tin voor dit doel.
Stralingsbescherming
Lood is een zeer geschikt metaal voor bescherming tegen g-straling. Het heeft een hoge dichtheid, en hoe hoger de dichtheid van een materiaal, hoe geringer de transparantie voor deze straling. Bovendien is lood relatief goedkoop.

Dakbedekking
Lood is gemakkelijk te verwerken. Het is eenvoudig in de juiste vorm te ‘kloppen’ (hameren) en beschadigt niet bij uitzetten en krimpen. Bovendien is het zeer corrosiebestendig. Door deze combinatie van eigenschappen is het een populair waterkerend bouwmateriaal. Het verzorgt de afvoer van regenwater bij dakaansluitingen, spouwmuren, dakkapellen en schoorstenen.

Voor dakbedekking wordt ook gebruik gemaakt van staalplaat bedekt met een laag lood-tinlegering (15 – 20 % tin). Vanwege het lage smeltpunt (328 °C) is deze legering gemakkelijk met een gewone gasvlam te lassen of zelfs te gieten.
Springstof
Loodazide, Pb(N3)2, kan als explosief gebruikt worden in detonatoren voor vele soorten munitie.
Menie
Menie is een roestwerende laag die op staal wordt aangebracht. In zogenaamde loodmenie is loodoxide (Pb3O4) verwerkt.

Deze laag is in staat zowel kathodisch als anodisch te beschermen, omdat er Pb2+– en Pb4+– ionen in voorkomen. Ook Ca2PbO4 wordt als roestwerende stof in verf (primer) toegepast. Overigens is het gebruik van lood in bedrijfsmatig toegepaste meniesoorten verboden.
Kristalglas
Bij het bereiden van kristalglas wordt, naast de gewone componenten (zie 19 – Kalium) minstens 24 % loodoxide (PbO) of een andere loodverbinding toegevoegd. Dit resulteert in een glasstructuur die na slijpen een prachtige schittering geeft. Dit (lood)glas heeft een hoge brekingsindex en wordt daarom ook gebruikt voor speciale lenzen.
Bepaling ouderdom botten
Aan de hand van onderzoek naar de isotopen 210Pb en 210Po (met een halveringstijd van 22 jaar respectievelijk 134 dagen) is het mogelijk om de ouderdom van relatief jonge botten (50-100 jaar) vast te stellen. De C14-methode (zie element 6 – koolstof) is hiervoor minder geschikt.
Meer toepassingen
Als element en in legeringen
- Geluidsisolatie
- Orgelpijpen (met Sn)
- Zekeringen (met Bi)
In verbindingen
| Email, glazuur | PbS | |||
| Halfgeleiders | PbS, PbSe, PbTe | |||
| Katalysator bij de polymerisatie van polyurethaan | PhPb(OAc)3 | |||
| Keramiek | PbSi2O5 | |||
| Toevoeging aan verf voor zeeschepen | Ph3Pb(OAc) | |||
| Vuurwerk (oxidator) | PbO2 |
Naam & ontdekking
Naam
De naam lood is waarschijnlijk afgeleid van het Keltische loud, het Ierse luaide of van het Sanskriet loka. dat roodachtig betekent. Dit vanwege de roodachtige kleur van het oxide (menie). Het symbool Pb is afkomstig van de Latijnse naam voor lood, plumbum (nog wel gebruikt in wetenschappelijke benamingen).

Ontdekking
Lood was reeds in de Oudheid bekend. In het bijbel boek Exodus is al sprake van lood; in het bijbel boek Job wordt het genoemd als schrijfmateriaal. Dit gebruik is ook nog terug te vinden in het woord ‘potlood’.
In Egypte gebruikte men omstreeks 3000 v. Chr. loodverbindingen bij het glazuren van aardewerk en voor cosmetica. Voor deze laatste toepassing dienden onder andere de mineralen galena en cerussiet. In alabaster potjes in de Egyptische koningsgraven zijn laurioniet (PbOHCl) en fosgeniet (Pb2Cl2CO3) aangetroffen. Deze verbindingen werden gemaakt uit het rode loodoxide, gemalen loodmineralen en koolzuurrijk zeewater.
De Romeinen produceerden naar schatting tot wel 80.000 ton lood per jaar. Ze pasten het toe in standaardgewichten en munten en in allerlei gebruiksvoorwerpen zoals borden, drinkbekers en kookpotten. De Romeinen waren hun tijd ver vooruit met een drinkwatervoorziening waarbij ze loden pijpen gebruikten. (Van het gebruik bij waterleidingen – en de wijze van verwerking – is het woord loodgieter afkomstig).

De Romeinen pasten loodoxide veelvuldig toe als pigment en gebruikten waarschijnlijk loodverbindingen als zoetstof en conserveringsmiddel. Dit was allemaal niet ongevaarlijk: bepaalde beschrijvingen van ziektebeelden in die tijd doen denken aan de symptomen van loodvergiftiging. Sommige historici schrijven de teloorgang van het Romeinse rijk (voor een deel) toe aan het veelvuldig toepassen van lood.
De Grieken wonnen looderts op Rhodos (ca. 550 v.Chr.), de Romeinen hadden loodmijnen in Italië Spanje en Frankrijk.
Voorkomen
Voorkomen
Lood komt op vele plaatsen op aarde voor. Met een aandeel van 1,4.10-3 % van de aardkost (op gewichtsbasis) staat het op plaats 36 in lijst van meest voorkomende elementen.

De belangrijkste mineralen zijn:
| Anglesiet (foto) | PbSO4 | |||
| Cerussiet | PbCO3 | |||
| Cotunniet | PbCl2 | |||
| Crocoïet | PbCrO4 | |||
| Galena, loodglans of loodspies | PbS | |||
| Litharge | PbO | |||
| Menie | Pb+22Pb+4O4 | |||
| Penfieldiet | Pb2Cl3(OH) | |||
| Pyromorfiet | Pb5(PO4)3Cl | |||
| Raspiet | PbWO4 | |||
| Vanadiniet | Pb5(VO4)3Cl |
Winning
De belangrijkste wingebieden liggen in Australië, China, de Verenigde Staten van Amerika, Rusland, Canada, Mexico, Peru, het voormalig Joegoslavië, Bulgarije en Marokko. In Polen, Duitsland en Oostenrijk wordt op bescheiden schaal looderts gewonnen. De EU heeft met de Critical Raw Materials Act in 2022 het element lood op de lijst van schaarse en strategische grondstoffen gezet.
Bereiding
Bereiding
Vroeger
Lood werd bereid door het roosten van loodglans, gevolgd door reductie van het ontstane oxide met kool.

Tegenwoordig
Lood is te bereiden door galena of loodglans te roosten (op 100 °C), Het verkregen loodoxide wordt vervolgens in een hoogoven gereduceerd met cokes:
Het zo verkregen vloeibare materiaal bevat diverse verontreinigingen.
Koper is te verwijderen door de smelt tot net boven het smeltpunt af te koelen. Daarbij ontstaat een vaste koek die van de vloeistof is af te halen.
Tin, arseen en antimoon worden geoxideerd, waarbij een slak van oxiden ontstaat.
Door toevoegen van zink, gevolgd door langzaam afkoelen zijn zilver, goud en bismut te verwijderen. Deze metalen lossen op in het zink en na verloop van tijd vormt zich een makkelijk te verwijderen slak met verontreinigd zink bovenop de vloeistof.
Het uiteindelijk verkregen lood is nog verder te zuiveren via vacuümdestillatie, of door elektrolyse met ruw lood als anode en PbSiF6 als elektrolyt. Op de kathode vormt zich dan 99,99 % zuiver lood.
Lood is ook te verkrijgen door loodoxide en -sulfide in de juiste verhouding te smelten: